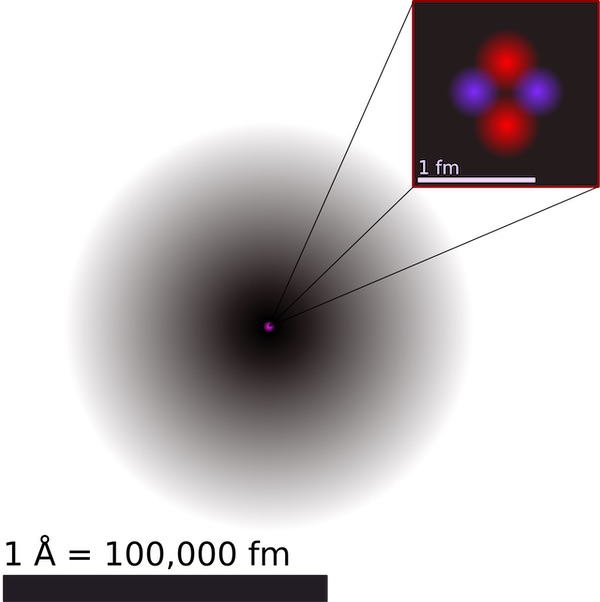
Больше электронов чем протонов содержит
Тест по теме «Атом»
Просмотр содержимого документа
«Тест по теме «Атом»»
Больше электронов, чем протонов содержит частица, символ которой:
Выберите один из 4 вариантов ответа:
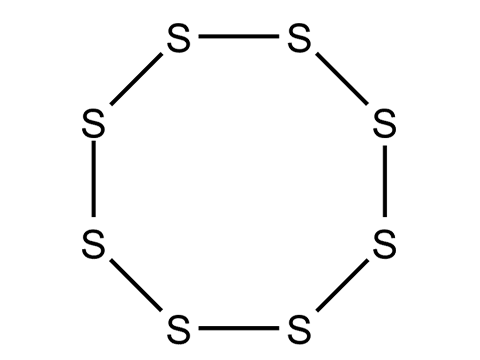
В молекуле Sx содержится 64 электрона. Укажите значение х.
Чем различаются между собой нуклиды 79 Br и 81 Br?
Выберите несколько из 4 вариантов ответа:
1) числом нейтронов
2) протонным числом
3) числом электронов
Укажите символы элементарных частиц:
Выберите несколько из 4 вариантов ответа:
Один из нуклидов меди содержит 36 нейтронов, массовое число этого нуклида равно:
Выберите один из 4 вариантов ответа:
В электронейтральном атоме число протонов всегда равно:
Выберите несколько из 4 вариантов ответа:
1) сумме чисел нейтронов и электронов
3) числу электронов
4) разнице между нуклонным числом и числом электронов
Укажите символ самой тяжёлой частицы:
Выберите один из 4 вариантов ответа:
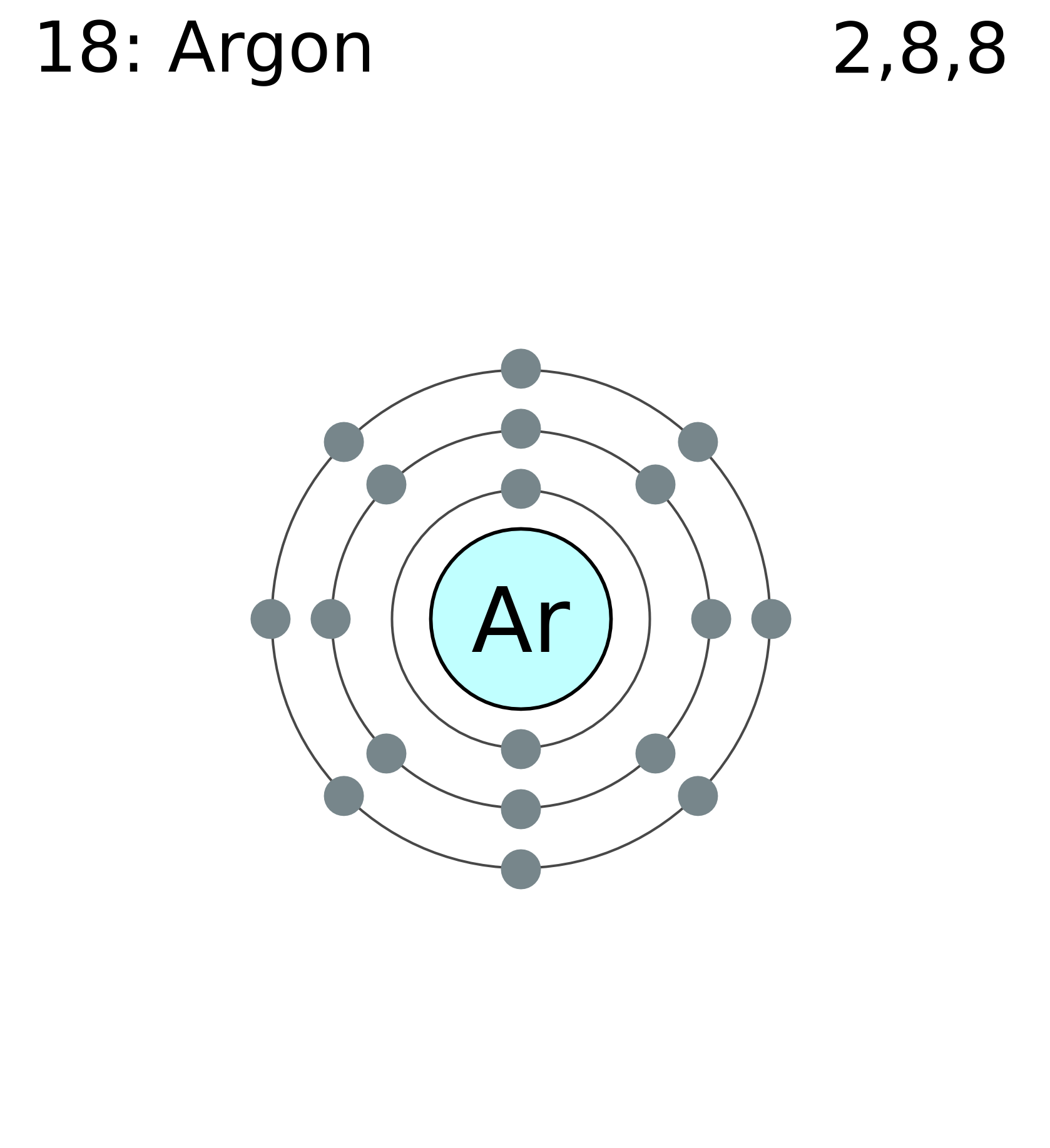
Запишите сумму всех элементарных частиц в нуклиде 40 Ar.
Массовая доля атомов водорода наибольшая в составе молекулы, формула которой:
Выберите один из 4 вариантов ответа:
Заряд ядра определяется числом:
Выберите один из 4 вариантов ответа:
15 самых интригующих фактов об атомах
Все во Вселенной — от ядра Земли до самых дальних галактик — состоит из атомов. Это фундаментальная единица элемента.
К настоящему времени было идентифицировано 118 элементов (все они перечислены в периодической таблице).
Слово «атом», означающее «неделимый», происходит от древнегреческого слова «ἄτομος». Древнегреческие философы считали, что атом невозможно разделить на что-то меньшее. Однако ученые доказали этот факт неправильно в начале 20 века, когда они открыли субатомные частицы (электроны, протоны, нейтроны).
Ниже мы перечислили некоторые из наиболее интригующих фактов об атомах, которые только сделают вас умнее. Так что давайте начнем с самого короткого и простого.
1. Состав атомов
Каждый атом содержит одно ядро [в центре] и один или несколько электронов. Ядро обычно состоит из равного числа протонов и нейтронов, вместе называемых нуклонами.
2. Ядро содержит почти всю массу
Ядро, расположенное в центре атома, составляет более 99,9 % его массы, но занимает лишь одну триллионную его общего объема. Таким образом, большая часть пространства внутри атома пуста.
3. Электроны чрезвычайно малы
Электрон является наиболее активным компонентом атома, но он почти ничего не вносит в массу атома. Например, в атоме водорода масса электрона составляет всего 0,0005 массы ядра.
4. Атом может иметь электрический заряд
Электроны несут отрицательный заряд, протоны несут положительный заряд, а нейтроны не имеют электрического заряда. Атом электрически нейтрален, если он имеет одинаковое количество электронов и протонов.
Однако, если атом имеет меньше или больше протонов, чем электронов, он имеет общий положительный или отрицательный заряд (известный как Ион).
5. Что удерживает протоны и нейтроны вместе?
Ядерная сила удерживает протоны и нейтроны вместе в ядре атома. Электроны притягиваются к протонам другой силой, называемой электромагнитной силой, которая слабее ядерной силы.
6. 94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя некоторые встречаются в незначительных количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
7. Каждый атом уникален
Каждый атом содержит определенное количество протонов в ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра содержат 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные характеристики зависят от количества электронов в атоме.
8. Самый большой и самый маленький атом
Самым большим элементом (по размеру) является Франций, но поскольку он крайне нестабилен, предпочтение отдается Цезию. У него большая валентная оболочка и относительно менее эффективный заряд ядра.
Иллюстрация атома гелия | Предоставлено: Викимедиа.
9. Самый тяжелый и легкий атом
Оганессон, однако, является самым тяжелым синтетическим химическим элементом. Самым тяжелым природным элементом является Уран с атомным весом 238,029.
Элемент, который имеет самый легкий атом-это водород. У него есть только один протон, обращающийся вокруг одного электрона. Его самый распространенный изотоп, известный как Протий, состоит из одного протона и нулевых нейтронов.
10. Возможно ли преобразовать один элемент в другой?
В некоторых экстремальных условиях электромагнитная сила (которая отталкивает электроны и протоны) преодолевает сильную ядерную силу, выбрасывая нуклоны из атомного ядра и оставляя после себя совершенно другой элемент. Это именно то, что происходит при делении ядер.
Однако этот процесс [распада] является дорогостоящим и опасным. Ученые пока не смогли безопасно генерировать энергию с помощью ядерного деления.
11. Атомы в человеческом теле
Тело человека весом 70 кг состоит из 7 × 10 27 атомов. Три атома (водород, кислород и углерод) составляют до 99 процентов от общего количества.
12. Сколько атомов существует во Вселенной?
Наблюдаемая вселенная огромна: она охватывает приблизительно 93 миллиарда световых лет. Согласно теоретической оценке, в нашей вселенной насчитывается от 10 78 до 10 82 атомов.
Это не какой-то выдуманный номер. Расчеты основаны на достоверных данных (что мы знаем о вселенной). Однако между этими оценками существует огромная разница, что говорит о значительной степени ошибки. Более точные цифры будут доступны, когда мы узнаем больше о космосе.
13. Радиоактивные атомы
В нестабильном атоме силы неуравновешенны. В этом случае атомное ядро содержит избыток либо протонов, либо нейтронов. Атом пытается достичь стабильного состояния, выбрасывая свои дополнительные частицы или высвобождая энергию в других формах. Элементы, содержащие такие нестабильные ядра, называются радиоактивными.
Фермий, например, является радиоактивным элементом: его самый стабильный изотоп (Fm-257) имеет период полураспада 100,5 суток.
14. Видя атомы
Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом.
Сканирующий туннельный микроскоп захватывает атомы кремния на поверхности кристаллического карбида кремния
Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах.
15. Квантовая природа атомных свойств
Поскольку атомы чрезвычайно малы по размеру, они проявляют квантовые свойства, поэтому предсказание их поведения с применением классической физики всегда приведет к неверным результатам.
Когда электрон прыгает с одного энергетического уровня (орбиты) на другой, он не перемещается в пространстве между ними. Вместо этого он исчезает с одной орбиты, а затем сразу же появляется на другой орбите.
Чтобы лучше описать и оценить их поведение, несколько атомных моделей включили в себя законы квантовой физики.
Атом — его состав и структура
Атом — основная единица элементов. Состав атома и его строение определяет различные свойства элементов. Например, состав атома кристалла кремния будет отличаться от структуры, что представляет, например, вещество уран.
Слово «атом» происходит от греческих корней «а»(без) и «том» (вырезать) что означает «неделимый». Вплоть до 20-го века атомы считались минимально возможными частицами.
Структура атома
Ядро является центральным, очень плотным компонентом атома. Оно состоит из протонов и нейтронов (совместно называемых нуклонами) и отвечает за большую часть атомной массы. 
Атомы невообразимо малы, а их ядра в 1000 раз меньше. На самом деле один кубический сантиметр кремния, содержит приблизительно 5 х 10 22 атома (это 5 с 22 нулями после него!). Это масштабы Вселенной, чтобы увидеть визуальное представление о том, насколько они малы.
Протоны
Протоны — это положительно заряженные частицы, которые находятся внутри ядра атома.
Элемент можно распознать по числу протонов в ядре одного из своих атомов. Кроме того, число протонов определяет место элемента в периодической таблице элементов. Например, состав атома углерода имеет ровно 6 протонов в своем ядре и, таким образом, номер 6 в периодической таблице элементов, торий имеет ровно 90 протонов и, таким образом, номер 90 в периодической таблице элементов.
Протоны отталкиваются друг от друга электромагнитной силой, но стягиваются вместе сильной силой, которая сильнее на коротких расстояниях (эти расстояния составляют около ферми или 10-15 м). Протоны очень маленькие, около 10-15 м в 10 000 раз меньше атома! Несмотря на свои невероятно малые размеры, протоны толкают друг друга с огромной силой, около 100 Н, сравнимой с весом маленькой собаки!
Заряд протона в точности равен и противоположен заряду электрона. Поэтому число электронов в нейтральном атоме всегда равно числу протонов. Протоны состоят из более мелких частиц, называемых кварками, которые также составляют нейтроны.
Число протонов в ядре называется атомным номером, и это число определяет, каким элементом является вещество. Другими словами, изменение числа протонов, изменяет элемент. Это число протонов (атомный номер) изменяется, когда ядро подвергается бета-распаду или альфа-распаду в любой из его различных форм.
Сложность намеренного изменения количества протонов в ядре велика. Вот почему алхимия (средневековая практика превращения свинца в золото) так долго терпит неудачу!
Нейтроны
Нейтроны имеют ту же массу, что и протоны, что делает их легко определяемыми, сколько находятся в составе ядра атома.
Простое вычитание числа протонов из атомной массы атома даст число нейтронов. Например, цезий является номером 55 в периодической таблице элементов и, следовательно, имеет 55 протонов; кроме того, его атомная масса (обычно также найденная в периодической таблице), как известно, составляет 133 (единицы атомной массы). Вычитание 55 из 133 дает 78, то есть число нейтронов в атоме. Один и тот же тип атома (определяемый количеством протонов) может иметь разное количество нейтронов. Они называются различными изотопами атома. Например, углерод-12 является одним изотопом углерода, а углерод-14 — другим изотопом углерода.
Имеется общее название составляющих атомного ядра. Нуклон — частица из протона и нейтрона, которые образуют ядро. Нуклиды — совокупность атомов с определенным значением нейтронов и протонов: одинаковое число протонов, но разным числом нейтронов. Нуклоны и нуклиды разные понятия.
Электроны
Электроны — это отрицательно заряженные частицы, которые существуют в облаке вокруг ядра атома. 
Состав атома определяет одинаковое количество протонов и электронов, однако он может потерять или приобрести электрон(ы) становится «несбалансированным». Неуравновешенный атом называется ионом; если он получает электрон (таким образом, имея их больше, чем протонов), он становится отрицательно заряженным ионом или анионом. Если происходит обратное, и атом теряет электрон, он становится положительно заряженный ион или катион. Ионы могут соединяться с другими ионами, создавая большое разнообразие различных смесей.
Один из способов, при котором состав атомов получает или теряет электроны, — это излучение высокой энергии. Это излучение вызывает образование ионов и в результате называется ионизирующим излучением.
Электроны и электричество
Электричество — это поток электронов через проводник, обычно в виде проволоки, этот поток называется электрическим током.
Чтобы этот поток произошел, электроны должны разорвать свою атомную связь (электричество — это поток электронов, а не их поток с ядрами, с которыми они связаны). Разрыв атомной связи между электроном и его ядром требует ввода энергии, которая заставляет электрон преодолевать электромагнитную силу, сдерживающую его, и таким образом свободно течь.
Проводящий материал
Все формы материи содержат электроны, однако в некоторых материалах они более свободно связаны с их ядрами. Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанные электроны требуют гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Что генерирует поток электронов?
Поток электронов можно генерировать различными способами, но основные из них следующие:
Таким образом, структура или состав атома определяет принадлежность к тому или иному химическому элементу.
Бессмертна ли материя?
Живые существа смертны. Даже звезды умирают. Тем не менее, говорят, что мы сделаны из звездной пыли. Может ли умереть сама материя?
Материя состоит из атомов, которые сами состоят из ядра, содержащего протоны и нейтроны с вращающимися вокруг него электронами: это область элементарных частиц. Эти частицы не умирают, хотя и могут распадаться. Из 400 или около того известных элементарных частиц только протон, электрон и нейтрино, по-видимому, бессмертны.
В чем разница между смертью и распадом частицы?
К счастью, большинство частиц, протонов и электронов, не распадаются априори. Почему? Это очередное следствие законов сохранения.
Великое объединение предсказывает распад протонов
Все это положило бы конец дискуссии, если бы не было физиков-теоретиков, стремящихся объяснить все физические явления на основе великих принципов. При этом они осмеливаются представить, что протоны смертны.
Одной из первых целей теоретического подхода является унификация сил, т.е. приведение всех известных взаимодействий в единую структуру. Существуют четыре фундаментальные силы: гравитация Ньютона, электромагнитная сила, действующая между заряженными частицами (Максвелл объединил законы электричества и магнетизма в своих уравнениях электромагнетизма), сильная сила, которая скрепляет протоны и нейтроны внутри ядер, и слабая сила, преобладающая для нейтрино. Электромагнитная сила и слабая сила были объединены в 1970-х годах в так называемую «электрослабую» силу, которая была подтверждена экспериментально в 1983 году. Таким образом, теперь существует только три независимые силы (гравитация, сильная сила, электрослабая сила), и вскоре после 1970 года теория заинтересовалась следующим шагом: объединением сильной и электрослабой сил. Новая теория была названа «великим объединением». Единственная загвоздка в том, что это явно нарушает сохранение барионного заряда.
Напомним, что барионный заряд является единственной гарантией бессмертия протонов. В контексте великого объединения это ограничение исчезает, и протон может распадаться, например, на нейтральный пион и позитрон. Если протон распадется, материя может исчезнуть со временем.
Этот процесс трансгрессивен более чем в одном: он не только нарушает барионный заряд, но и преобразует материю (протон) в антиматерию (позитрон), при этом получающийся пион является чистой энергией. Однако позвольте нам успокоиться, теория вычислила продолжительность жизни этого распада протона более 10 31 лет, то есть в триллионы миллиардов раз больше возраста нашей Вселенной, возраст которой составляет 14 миллиардов лет.
Как измерить такую гигантскую продолжительность жизни?
При такой продолжительности жизни только один протон из 10 21 исчез бы со времен Большого взрыва. Для примерно 10 29 протонов, присутствующих в тонне воды, в год распадается менее одного протона.
При распаде протона образуются позитрон и нейтральный пион; освобожденный пион быстро превращается в 2 фотона. Энергии достаточно, чтобы вызвать эффект Черенкова: в резервуар с водой детектора излучается световой сигнал, который может быть обнаружен. Этот метод позволяет с большой эффективностью искать предполагаемый процесс распада протонов. Однако, после нескольких лет тщательного изучения, никакого распада не наблюдалось, что привело к ограничению времени жизни протона в 10 34 года. Таким образом, мы знаем, что после Большого взрыва из 10 000 миллиардов миллиардов звезд, населяющих небосвод, исчезла менее доли звезды, иными словами, почти ничего.
Таким образом, в масштабах Вселенной кажется, что протон бессмертен, и поэтому в нашем мире не будет недостатка материи для его создания. Что касается электронов, то никто не предполагал, что они могут исчезнуть.
Атомы, ионы, молекулы
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов. Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд. Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.
Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода. Молекула – наименьшая частица вещества, обладающая его химическими свойствами, состоящая из двух или более атомов Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы. Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями.
Но для ученых прошлого, пытавшихся решить два основных вопроса:
Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
Вывод из статьи про Атомы, ионы, молекулы