что такое mno2 в химии
Диоксид марганца
Диоксид марганца
| Диоксид марганца | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Диоксид марганца |
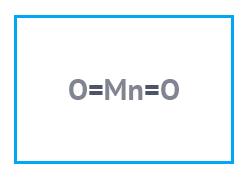
| Химическая формула | MnO2 |
| Отн. молек. масса | 86,9368 а. е. м. |
| Молярная масса | 86,9368 г/моль |
| Физические свойства | |
| Плотность вещества | 5,026 г/см³ |
| Состояние (ст. усл.) | черные тетрагональные кристаллы |
| Термические свойства | |
| Температура разложения | 535 °C |
| Энтальпия (ст. усл.) | -521,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в воде 89,9 (при 0°С) г/100 мл |
| Классификация | |
| номер CAS | [1313-13-9] |
Диоксид марганца (MnO2, оксид марганца(IV), «двуокись марганца» (устар.)) — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре.
Содержание
Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными оксилителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ :
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия образуется черный осадок соли Mn(SO4)2. При сплавлении с щелочами и основными оксидами MnO2 выступает в роли основного оксида, образуя соли манганиты:
Получение
В лабораторных условиях получают термическим разложением перманганата калия.
Также можно получить реакцией перманганата калия с пероксидом водорода.
Литература
См. также
Полезное
Смотреть что такое «Диоксид марганца» в других словарях:
марганца диоксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
марганца(IV) оксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Оксид марганца(IV) — Общие … Википедия
МАРГАНЕЦ (химический элемент) — МАРГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55Mn.… … Энциклопедический словарь
Пиролюзит — Формула MnO2 Цвет Стальной серый, голубовато серый Цвет черты Чёрная Блеск Полуметаллический … Википедия
ЭЛЕКТРОСИНТЕЗ — (электрохимический синтез), способ получения хим. соед. в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит).… … Химическая энциклопедия
Соляная кислота — Модель молекулы хлороводорода Соляная кислота (хлороводородная, хлористоводородная, хлористый водород) … Википедия
Е507 — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлоридная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Оксид марганца(IV)
| Оксид марганца(IV) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Диоксид марганца |
| Химическая формула | MnO2 |
| Физические свойства | |
| Состояние (ст. усл.) | черные тетрагональные кристаллы |
| Отн. молек. масса | 86,9368 а. е. м. |
| Молярная масса | 86,9368 г/моль |
| Плотность | 5,026 г/см³ |
| Термические свойства | |
| Температура разложения | 535 °C |
| Энтальпия образования (ст. усл.) | -521,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в воде 0 (при 0 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | [1313-13-9] |
Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Содержание
Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ :
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2.
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты:
Является катализатором разложения пероксида водорода:
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике эта реакция не представляет особого интереса т.к. образовавшийся MnO2 каталитически разлагает пероксид водорода, не оставляя возможности провести реакцию до конца.
При температуре выше 100 °C восстановлением перманганата калия водородом:
Литература
См. также
Полезное
Смотреть что такое «Оксид марганца(IV)» в других словарях:
Оксид марганца(II) — Общие … Википедия
Оксид марганца(II,IV) — Общие Систематическое наименование Оксид марганца(II,IV) Традиционные названия Окисел марганца Химическая формула Mn5O8 Физические свойства … Википедия
Оксид марганца(VI) — Общие Систематическое наименование Оксид марганца(VI) Традиционные названия Окисел марганца Химическая формула MnO3 Физические свойства Состояние … Википедия
Оксид марганца (II) — Оксид марганца(II) Общие Систематическое наименование Оксид марганца(II) Традиционные названия Манганозит (минерал), окись марганца, монооксид марганца Химическая формула MnO … Википедия
оксид марганца — (MnO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN manganese oxide … Справочник технического переводчика
Оксид марганца(VII) — Mn2O7 зеленовато бурая маслянистая жидкость (tпл=5,9 °C), неустойчив при комнатной температуре; сильный окислитель, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Получить оксид марганца(VII) Mn2O7 можно… … Википедия
Оксид марганца(III) — Общие Систематическое наименование Оксид марганца(III) Традиционные названия Окисел марганца Химическая формула Mn2O3 Физические свойства … Википедия
Оксид марганца(II,III) — Общие Систематическое наименование Оксид марганца(II,III) Традиционные названия Окисел марганца Химическая формула Mn3O4 Физические свойства … Википедия
Марганца оксиды — Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO 1780 °C зеленый Оксид марганца(II,III) Mn3O4 1590 °C коричневый Оксид марганца(II,IV) Mn5O8 … Википедия
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Марганец двуокись — соединение, применяемое с зарождения человечества
Двуокись марганца — неорганическое соединение, оксид 
Свойства
Тонкодисперсионный или мелкокристаллический порошок темно-коричневого или черного цвета. Не растворяется в воде. Разлагается при нагревании свыше +105 °С. Токсичен.
Химически реактив очень устойчив, считается самым стабильным кислородосодержащим соединением марганца. В нормальных условиях вступает в реакции слабо. Проявляет амфотерные свойства, т.е. образует как кислоты, так и щелочи. Может проявлять себя как восстановитель, но чаще как сильный окислитель. Реагирует с сильными неорганическими и органическими кислотами, такими как серная, соляная, азотная, щавелевая с образованием солей: сульфатов, хлоридов, нитратов, оксалатов. В реакции с соляной кислотой выделяется хлор. С азотной и серной кислотами — кислород. Взаимодействует с сильными окислителями. В реакциях со щелочами образует соли марганцовистой (Н2МпО3) кислоты — манганиты.
 |  |  |
| Марганец двуокись 80% (45 мкр) | Респиратор пылезащитный ЛЕПЕСТОК Л-200 до 4ПДК | Марганец двуокись 91% ЭДМ |
Меры предосторожности
Относится ко 2-му классу опасности для здоровья человека. Может попасть внутрь при вдыхании пылевого аэрозоля. Вызывает раздражение при контакте с кожей. При проглатывании или вдыхании накапливается в организме. Высокая доза попавшего в организм реактива оказывает негативное воздействие на органы дыхания, центральную нервную и сердечно-сосудистую системы. По правилам техники безопасности, установленных ГОСТом, при работе с диоксидом марганца следует использовать спецодежду, резиновые перчатки и респираторы типа «Лепесток» с противопылевым фильтром, защитные очки. В воздухе рабочей зоны следует регулярно проверять концентрацию реактива. Само помещение должно быть снабжено принудительной вентиляцией.
Хранят и транспортируют двуокись марганца во влагостойких мешках, бумажных с пропиткой или пластиковых, а также в стальных контейнерах и картонно-навивных барабанах. Хранят на крытых складах.
Что такое mno2 в химии
Оксид марганца (IV) MnO2 – наиболее устойчивое соединение марганца, кристаллическое вещество черно-бурого цвета, широко распространено в земной коре в виде минерала пиролюзит. В зависимости от условий образования существует в различных полиморфных модификациях, отличающихся физическими свойствами. При нагревании разлагается, постепенно отцепляя кислород и образуя оксид марганца (III), оксид марганца (II, III) и оксид марганца (II).
При 170°С восстанавливается водородом:
Обладает амфотерными свойствами. При сплавлении со щелочами или основными оксидами образует манганиты:
в присутствии кислорода – манганаты:
При нагревании с кислотами не образует аквакомплексы Mn (IV), а проявляет окислительные свойства, например:
При взаимодействии с серной или азотной кислотой оксид марганца (IV) разлагается с выделением кислорода:
В присутствии сильных окислителей проявляет восстановительные свойства:
Получается термическим разложением нитрата марганца (II) на воздухе:
или восстановлением перманганата калия в нейтральной среде:
Гидроксид марганца (VI) – марганцоватистая кислота Mn(OH)4 (H4MnO4), H2MnO3 – неустойчивое соединение, проявляет амфотерные свойства.
Соли марганца (IV). Существуют соли марганца (IV), в которые марганец входит в состав катиона, например, Mn(SO4)2 получается окислением сульфата марганца (II). Также марганец (IV) образует соли, в которые входит в состав аниона – это соли ортомарганцоватистой кислоты – ортоманганаты Na4MnO4 и соли метамарганцоватистой кислоты – метаманганаты BaMnO3. Манганаты неустойчивы, их трудно выделить в чистом виде.
Оксид марганца IV
| Оксид марганца IV | |
|---|---|
| Систематическое наименование | Диоксид марганца |
| Хим. формула | MnO2 |
| Состояние | черные тетрагональные кристаллы |
| Молярная масса | 86,9368 г/моль |
| Плотность | 5,026 г/см³ |
| Температура | |
| • разложения | 535 °C |
| Энтальпия | |
| • образования | -521,5 кДж/моль |
| Растворимость | |
| • в воде | нерастворим |
| Рег. номер CAS | [1313-13-9] |
| PubChem | 14801 |
| Рег. номер EINECS | 215-202-6 |
| SMILES | |
| RTECS | OP0350000 |
| ChEBI | 136511 |
| Номер ООН | 1479 |
| ChemSpider | 14117 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид марганца IV (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Содержание
Химические свойства
При обычных условиях диоксид марганца ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ :
Диоксид марганца проявляет амфотерные свойства. Так, в концентрированных сернокислых растворах образует сульфат марганца IV:
А при сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли — манганиты:
MnO2 + CaO ⟶ CaMnO 3
Является катализатором разложения пероксида водорода:
При нагревании выше 530°C разлагается:
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике образовавшийся MnO2 каталитически разлагает пероксид водорода, вследствие чего реакция до конца не протекает.
При температуре выше 100°C восстановлением перманганата калия водородом:









