что значит генная терапия
Что значит генная терапия
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
Генная терапия — метод лечения заболеваний, основанный на переносе в клетки организма определённых генов. Основная проблема генной терапии — разработка эффективного и безопасного способа переноса необходимых генов в дефектные клетки организма. В качестве «средств доставки» генов используют различные векторы, наиболее часто — различные вирусы (см. ниже). В настоящее время разработки генной терапии касаются только соматических клеток.
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
В 1992 г. в США осуществили введение в клетки печени человека гена белка-рецептора, адсорбирующего липопротеины низкой плотности в гепатоциты женщины, страдающей выраженным атеросклерозом (патология была связана с дефицитом липопротеинов вследствие генных нарушений). Посредством трансфекции ген был введён в гомогенизированные клетки печени, которые затем переносили в печень пациентки. После такой процедуры состояние женщины улучшилось, хотя до пересадки «генно-инженерной печени» она перенесла инфаркт (в 16 лет) и операцию на сердце (в 26 лет).
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Что значит генная терапия
Препарат Zolgensma был разработан швейцарской фармацевтической компанией Novartis. Он применяется одноразово и стоит 2 млн долларов. Врачи считают, что лекарство может дать начало массовому применению генной терапии: только за первые три месяца 2019 года было зарегистрировано 372 новых клинических испытания генно-терапевтических препаратов.
Для многих наследственных заболеваний нет эффективного лечения, существующие препараты помогают облегчить жизнь пациентов. Причиной таких заболеваний являются изменения генетического материала – мутации. В результате мутаций с гена синтезируется либо изменённый белок, который не может правильно выполнять свою функцию, либо белок не синтезируется вовсе. Для полного излечения пациентов необходимо исправить в их клетках мутации. Задачу немного упрощает тот факт, что для многих наследственных заболеваний неработающий белок оказывается критически важен только в одном месте организма. Поэтому достаточно исправить ген только в этом органе или ткани.
Генно-терапевтический подход к лечению наследственных заболеваний разрабатывается уже 40 лет. Основная технология генной терапии основана на замещении гена с мутацией правильно функционирующей копией этого гена. Но есть еще две стратегии: выключение неправильно работающего гена и введение нового гена, который поможет организму победить заболевание.
Надо подчеркнуть принципиальное отличие генной терапии от редактирования генома, которое сейчас тоже активно разрабатывается для лечения наследственных заболеваний. Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента.
В зависимости от цели генная терапия бывает соматической и фетальной. В первом случае вирус с геном вводят в клетки тела, во втором – в эмбрион на ранней стадии развития. В результате фетальной генной терапии генетический материал попадает во все клетки и может быть передан детям.
В ходе клинических испытаний препарат Zolgensma показал хорошие результаты у пациентов со спинальной мышечной атрофией: из 21 пациентов 19 смогли начать двигать головой и самостоятельно сидеть.
Препараты генной терапии могут стать эффективным средством лечения многих наследственных заболеваний, для которых не существовало лечения до этого. Так, в ближайшее время ожидает одобрения международного регулятора еще один новый генно-терапевтический препарат для лечения талассемии и серповидноклеточной анемии. Оба этих заболевания связаны с мутациями, результатом которых является синтез неправильно работающего гемоглобина – белка, переносящего кислород в крови.
Прежде всего, препараты генной терапии разрабатываются для заболеваний, причиной которых является одна в мутация в одном гене. Таких болезней 10 000. В связи с большими затратами на разработку генно-терапевтических препаратов, они очень дорогие. Но постепенно отработка технологии позволит значительно снизить стоимость таких лекарств и сделать их доступными большинству пациентов.
Просто о сложном: как работает генная терапия и что она лечит
Natalia Kudryavtseva
Порядка двухсот миллионов жителей планеты являются потенциальными кандидатами для генной терапии, а несколько тысяч уже стали пациентами-пионерами и в рамках испытаний получили лечение от ранее неизлечимых заболеваний. Кандидат медицинских наук, врач-терапевт Лаборатории регенеративной медицины Медицинского центра МГУ, старший научный сотрудник Факультета фундаментальной медицины МГУ, победитель «Научных боев» Политеха — 2015 Павел Макаревич объяснил T&P, как работает генная терапия и с какими проблемами сталкиваются ученые, разрабатывая этот принципиально другой метод лечения многих серьезных болезней.
Павел Макаревич
200 миллионов потенциальных кандидатов — это очень много. До половины случаев, в которых помогает генная терапия, это наследственные заболевания: гемофилия, иммунодефициты, болезни накопления, энзимопатия, 25–30% случаев — это онкологические заболевания, оставшиеся 20% — все остальное: кардиология, неврология, болезни нервной системы и даже травмы, например повреждения нерва или другие, более тяжелые случаи. Такое распределение связано с тем, что наследственные заболевания протекают крайне тяжело и зачастую имеют летальный исход, и там нет другого лечения в принципе, за исключением генной терапии.
В качестве лечебного действующего вещества в генной терапии используется генетическая информация, а точнее молекулы, которые ее несут: нуклеиновые кислоты РНК (реже) и ДНК (чаще). В каждой клетке есть «ксерокс» — экспрессионный аппарат — механизм, с помощью которого клетка переводит генетическую информацию в белки, позволяющие ей правильно функционировать. То состояние, когда есть правильный ген и хорошо работающий «ксерокс» (который вообще-то должен работать всегда, иначе такая клетка нежизнеспособна), с точки зрения генной терапии можно условно назвать здоровьем клетки. В любой клетке есть полная библиотека этих оригиналов — генов, которые клетка использует для правильной экспрессии белков и нормального функционирования. При патологии возможны самые различные ситуации. Например, когда по причине потерян важный оригинал (ген) или большая его часть и восстановить такую потерю уже невозможно. В такой ситуации развиваются такие заболевания, как, например, миодистрофия Дюшенна, которая приводит к прогрессивному параличу всех мышц тела и заканчивается смертью в 25–27 лет — как правило, от остановки дыхания.
Другой пример — небольшая «поломка», не такая фатальная, но тем не менее приводящая к тому, что этот белок не работает — не выполняет своей биологической функции. И если это, например, VIII фактор свертывания крови, то у человека развивается гемофилия. В обеих этих ситуациях наша задача — доставить в ткань «нормальную», рабочую копию гена, то есть как бы подложить в этот «ксерокс» правильный оригинал, чтобы наладить работу клетки и, может быть, целого организма, продлевая таким образом ему жизнь. Работает ли это? Да, такие подходы эффективны в экспериментах на животных и уже проходят стадии клинических испытаний на пациентах, хотя следует признать, что трудностей на пути хватает.
Мы также разрабатываем подходы для лечения ишемических заболеваний, которые гораздо более распространены, чем наследственная патология, хотя, несомненно, для них существует и множество других способов лечения. Дело в том, что каждый человек, который болеет ишемической болезнью сердца или конечностей, рано или поздно оказывается в состоянии, когда единственным способом лечения для него может оказаться генная терапия.
С помощью генной терапии лечится большая группа заболеваний, связанных с поражением центральной нервной системы, — болезнь Паркинсона, Альцгеймер, боковой амиотрофический склероз. Существуют вирусы, которые имеют склонность атаковать центральную нервную систему, и это свойство можно использовать во благо. Например, вирус герпеса живет в нервах, и с его помощью в нервную систему можно доставлять факторы роста и цитокины, которые замедляют развитие этих заболеваний. Это как раз пример того, когда вирус, вызывающий заболевание, редактируется, лишается белков, отвечающих за его патогенное действие, и используется как кассета, а факторы роста защищают нейроны от гибели, которая происходит при этих заболеваниях и становится причиной гибели больного. Таким образом получается, что вирусы, несущие гены факторов роста, замедляют прогресс болезни и продлевают жизнь пациента.
Или, например, слепота — состояние, которое полностью лишает человека зрительных образов на всю жизнь. Одна из причин слепоты — так называемая врожденная атрофия Лебера, которая развивается из-за мутации в гене RPE 65. В мире сейчас уже около 80 людей обрели минимальные зрительные возможности благодаря генной терапии — модифицированному аденовирусу, который доставил «рабочий» RPE 65 в ткани глаза и повысил его чувствительность к свету.
Как мы доставляем генетическую информацию в ткани: локально, в конкретный орган, или сразу в весь организм? Есть два варианта. Первый — это плазмида, то есть кольцевая молекула ДНК. Она супер спирализуется, становится очень маленькой и компактной, и мы «упаковываем» ее в химический полимер, чтобы облегчить ее проникновение в клетку. В чем здесь проблема? Плазмидная ДНК через 12–14 дней будет удалена из клетки, и продукция белка остановится. В такой ситуации мы можем предпринять два решения: первое — ввести дополнительную дозу плазмидной ДНК (благо она не иммуногенна), второе — ввести туда сразу несколько генов (например, для усиления эффектов цитокинов на регенерацию ткани), чтобы увеличить силу действия в тот короткий период времени, в течение которого будет идти продукция белков.
Получается, что у нас есть два очень мощных способа доставки гена, и вирус явно выглядит более предпочтительным, потому что он сам может находить свои мишени в организме: например, вирус гепатита найдет печень, а вирус герпеса — нейроны. Плазмида, кольцевая ДНК, работает только там, куда ее ввели. Возникает вопрос: почему мы до сих пор вообще пользуемся плазмидами, если есть вирусы? Ответ такой: вирусы иммуногенны, они вызывают иммунный ответ. И, как вариант, они могут быть либо уничтожены иммунной системой до того, как успеют сработать, либо, как худший вариант, они могут вызывать побочные действия — мощные иммунные реакции на введение вируса. Получается очень хрупкий баланс между эффективностью и безопасностью, который определяет судьбу препаратов, которые мы разрабатываем, и, если препарат показал себя небезопасным на этапе разработки, это тупик.
Чтобы разработать, получить и протестировать новый препарат для генной терапии, лаборатория или даже целый институт должны работать несколько лет. Это, мягко говоря, недешево, пока это штучное производство, и протоколы, если они не спонсируются разработчиком, очень дорогие. Есть два или три препарата, зарегистрированных в Европе, один в Японии, в России пока только один — «Неоваскулген», препарат для стимуляции роста сосудов.
Препараты, которые используются для генной терапии, имеют не изученную ранее фармакокинетику, фармакодинамику. Вся проблема в том, что на данный момент об этом накоплено очень мало информации по сравнению с тем, сколько ее вокруг обычных препаратов. Это означает, что все риски, связанные с генной терапией, теоретически должны учитываться при разработках. Допустим, мы знаем, что не нужно испытывать тысячекратную дозу аспирина на практике, и мы этого не делаем. В отношении генной терапии, поскольку мы пока не знаем фармакокинетику (а значит, и многих особенностей действия препаратов), мы должны учитывать все существующие возможные эффекты, и это сильно растягивает исследование во времени.
Вторая проблема заключается в том, что каждый препарат имеет свой уникальный тип действия. Это означает, что нужно доказывать его безопасность и эффективность на уникальных моделях, а это тоже растягивает период, после которого можно сказать: «Да, лекарство может быть выведено в клинику или на рынок, и это безопасно». Поэтому я считаю, что это во многом вопрос времени и опыта человечества в этой области, который, как и в любом drug-девелопменте, будет накапливаться ценой больших проблем: остановленных исследований, побочных эффектов. Но я также знаю, что это вопрос затраченных усилий сотен исследователей и потенциальный способ помочь миллионам людей. В настоящее время уже накоплен опыт и извлечены некоторые уроки, которые помогают идти дальше.
Генная терапия против рака
иллюстрация автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Благодаря стремительному развитию медицины создаются инновационные техники, лекарства, оборудование, направленные на лечение сложных заболеваний, таких как рак. В последнее время большое внимание уделяется генной терапии как перспективному методу лечения онкозаболеваний, который в будущем станет особо важным инструментом для предотвращения и снижения смертности от рака. В данной статье кратко рассматриваются пути развития болезни, а также применение инновационных техник генной терапии в онкологии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Благодаря Гиппократу и его наблюдательности (именно он увидел сходство опухоли и щупалец рака) в древних врачебных трактатах появился термин «карцинома» (грец. carcinos), или «рак» (лат. cancer). В медицинской практике по-разному классифицируют злокачественные новообразования: карциномы (из эпителиальных тканей), саркомы (из соединительной, мышечной тканей), лейкемия (в крови и костном мозге), лимфомы (в лимфатической системе) и другие (развиваются в других типах клеток, например, глиома — рак головного мозга). Но в быту более популярен термин «рак», который подразумевает любую злокачественную опухоль.
Мутации: погибнуть или жить вечно?
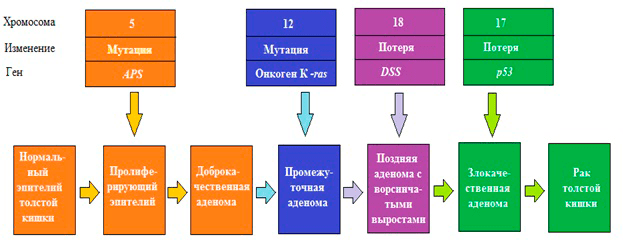
Многочисленные генетические исследования выявили, что возникновение раковых клеток — это результат генетических изменений. Ошибки в репликации (копировании) и репарации (исправлении ошибок) ДНК приводят к изменению генов, в том числе и контролирующих деление клетки. Основными факторами, которые способствуют повреждению генома, а в дальнейшем — приобретению мутаций, — являются эндогенные (атака свободных радикалов, образующихся в процессе обмена веществ, химическая нестабильность некоторых оснований ДНК) и экзогенные (ионизирующее и УФ-излучение, химические канцерогены). Когда мутации закрепляются в геноме, они способствуют трансформации нормальных клеток в раковые. Такие мутации в основном случаются в протоонкогенах, которые в норме стимулируют деление клетки. В результате может получиться постоянно «включенный» ген, и митоз (деление) не прекращается, что, фактически, означает злокачественное перерождение. Если же инактивирующие мутации происходят в генах, которые в норме ингибируют пролиферацию (гены-супрессоры опухолей), контроль над делением утрачивается, и клетка становится «бессмертной» (рис. 1).
Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].
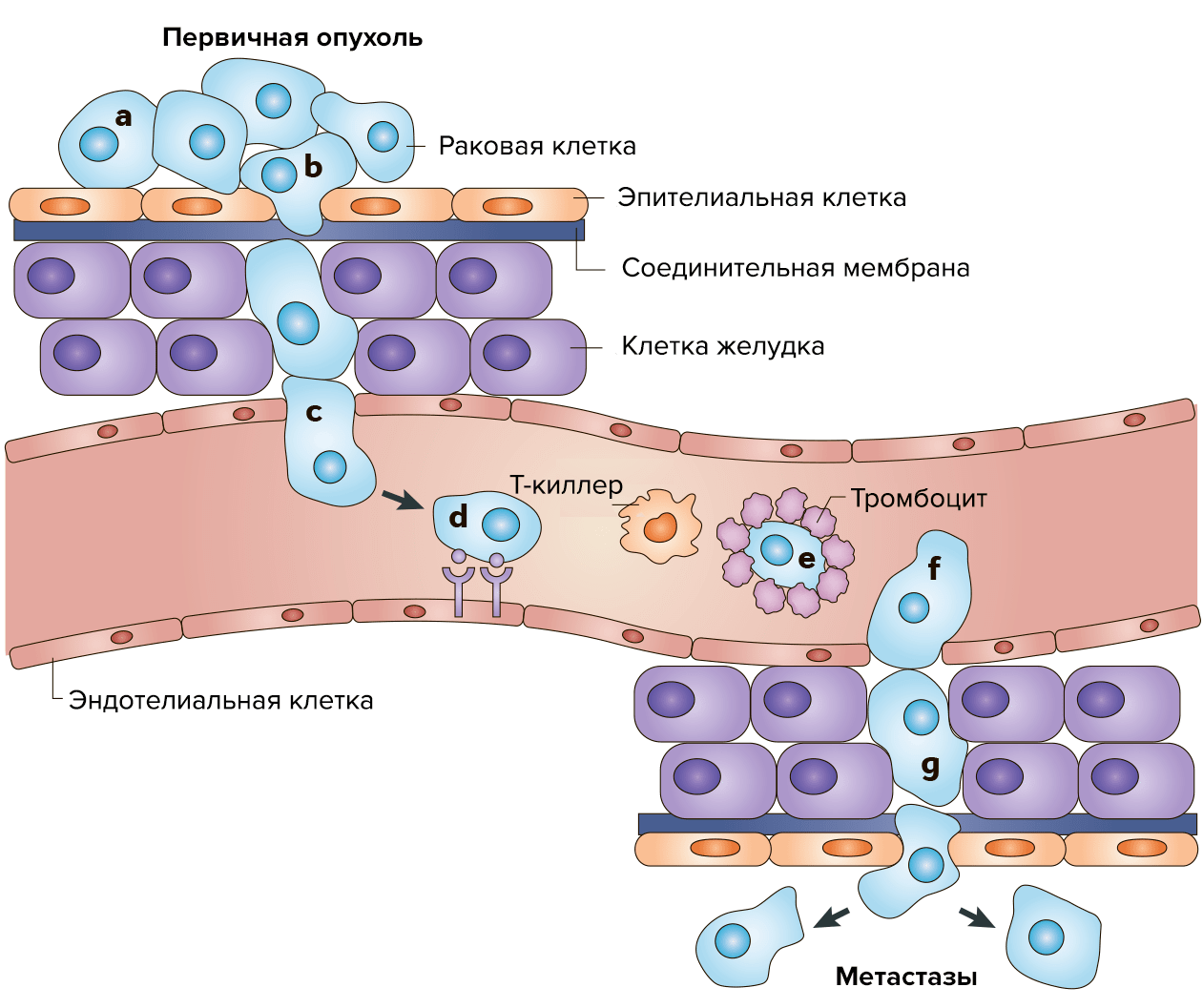
Результатом сбоя работы генов становится неконтролируемое деление клеток, а на последующих стадиях — метастазирование в различные органы и части тела по кровеносным и лимфатическим сосудам. Это достаточно сложный и активный процесс, который состоит из нескольких этапов. Отдельные раковые клетки отделяются от первичного очага и разносятся с кровью по организму. Затем с помощью специальных рецепторов они прикрепляются к эндотелиальным клеткам и экспрессируют протеиназы, которые расщепляют белки матрикса и образуют поры в базальной мембране. Разрушив внеклеточный матрикс, раковые клетки мигрируют вглубь здоровой ткани. За счет аутокринной стимуляции они делятся, образуя узел (1–2 мм в диаметре). При недостатке питания часть клеток в узле погибает, и такие «дремлющие» микрометастазы могут достаточно долго оставаться в тканях органа в латентном состоянии. В благоприятных условиях узел разрастается, в клетках активируются ген фактора роста эндотелия сосудов (VEGF) и фактора роста фибробластов (FGFb), а также инициируются ангиогенез (формирование кровеносных сосудов) (рис. 2).
Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
Традиционные методы и их недостатки
Если системы защиты организма не справились, и опухоль все-таки начала развиваться, спасти может только вмешательство медиков. На протяжении длительного периода врачами используются три основные «классические» терапии:
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
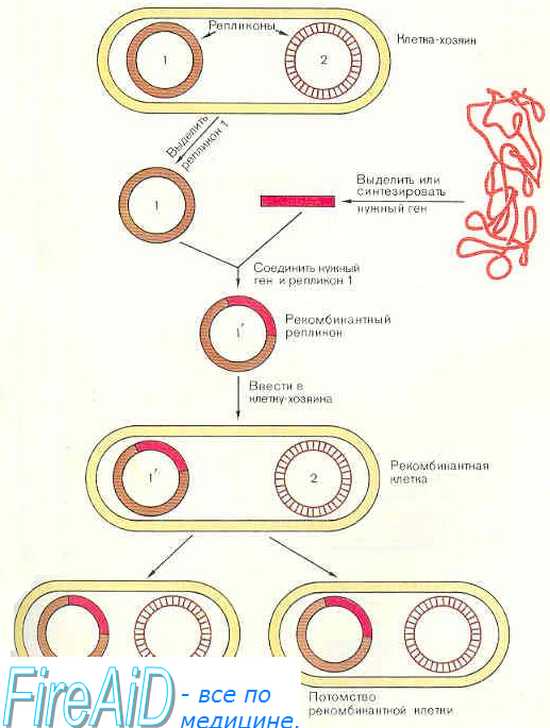
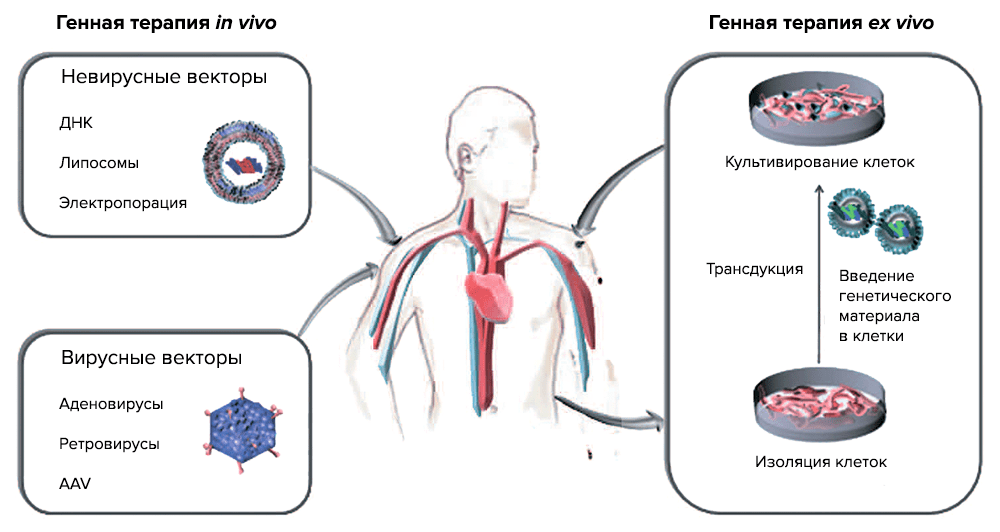
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).
Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые клетки или в ткани, которые окружают опухоль [9]. Генная терапия ex vivo состоит из выделения раковых клеток из пациента, встраивания терапевтического «здорового» гена в раковый геном и введения трансдуцированных клеток обратно в организм пациента. Для таких целей используются специальные векторы, созданные методами генной инженерии. Как правило, это вирусы, которые выявляют и уничтожают раковые клетки, при этом оставаясь безвредными для здоровых тканей организма, или невирусные векторы.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Для переноса трансгенных ДНК также применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц — используются для доставки препаратов с низкой молекулярной массой, например, олигонуклеотидов, пептидов, миРНК. Благодаря небольшим размерам, наночастицы поглощаются клетками и могут проникать в капилляры, что очень удобно для доставки «лечебных» молекул в самые труднодоступные места в организме. Данная техника часто используется для ингибирования ангиогенеза опухоли. Но существует риск накопления частиц в других органах, например, костном мозге, что может привести к непредсказуемым последствиям [11]. Самыми популярными невирусными методами доставки ДНК являются липосомы и электропорация.
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Базируется на введении в опухолевую ткань «суицидных» генов, в результате работы которых раковые клетки погибают. Данные трансгены кодируют ферменты, активирующие внутриклеточные цитостатики, ФНО-рецепторы и другие важные компоненты для активации апоптоза. Суицидная комбинация генов пролекарства в идеале должна соответствовать следующим требованиям [17]: контролируемая экспрессия гена; правильное превращение выбранного пролекарства в активное противораковое средство; полная активация пролекарства без дополнительных эндогенных ферментов.
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Широкое разнообразие вирусных и невирусных векторов для трансгенов позволяет экспериментировать над различными типами иммунных клеток (например, цитотоксическими Т-клетками и дендритными клетками) для ингибирования иммунного ответа и регрессии раковых клеток. В 1990-х годах было высказано предположение, что опухолевые инфильтрирующие лимфоциты (TIL) являются источником цитотоксических Т-лимфоцитов (CTL) и естественных киллеров (NK) для раковых клеток [19]. Так как TIL можно легко манипулировать ex vivo, они стали первыми генетически модифицированными иммунными клетками, которые были применены для противораковой иммунотерапии [20]. В Т-клетках, изъятых из крови онкобольного, изменяют гены, которые отвечают за экспрессию рецепторов для раковых антигенов. Также можно добавлять гены для большей выживаемости и эффективного проникновения модифицированных Т-клеток в опухоль. С помощью таких манипуляций создаются высокоактивные «убийцы» раковых клеток [21].
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Мощным инструментом генной терапии является использование стволовых клеток в качестве векторов для передачи терапевтических агентов — иммуностимулирующих цитокинов, «суицидных» генов, наночастиц и антиангиогенных белков [23]. Стволовые клетки (СК), кроме способности к самообновлению и дифференцировке, имеют огромное преимущество по сравнению с другими транспортными системами (нанополимерами, вирусами): активация пролекарства происходит непосредственно в опухолевых тканях, что позволяет избежать системной токсичности (экспрессия трансгенов способствует разрушению только раковых клеток). Дополнительным позитивным качеством является «привилегированное» состояние аутологичных СК — использованные собственных клеток гарантирует 100%-совместимость и повышает уровень безопасности процедуры [24]. Но все же эффективность терапии зависит от правильной ex vivo передачи модифицированного гена в СК и последующего переноса трансдуцированных клеток в организм пациента. Кроме того, прежде чем применять терапию в широких масштабах, нужно детально изучить все возможные пути трансформации СК в раковые клетки и разработать меры безопасности для предупреждения канцерогенного преобразования СК.
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Особенно перспективным методом лечения онкозаболеваний является генная терапия. На данный момент активно проводятся клинические испытания, которые часто подтверждают эффективность ГТ в тех случаях, когда стандартное противораковое лечение — хирургия, лучевая терапия и химиотерапия — не помогает. Развитие инновационных методик ГТ (иммунотерапии, онколитической виротерапии, «суицидной» терапии и др.) сможет решить проблему высокой смертности от рака, и, возможно, в будущем диагноз «рак» не будет звучать приговором.
Видео. Рак: узнать, предупредить и устранить болезнь