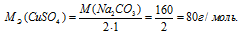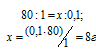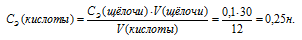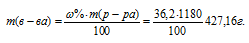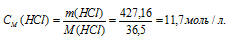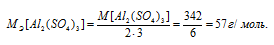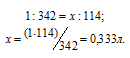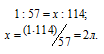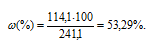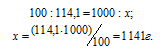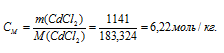2м раствор соляной кислоты означает что в раствора содержится кислоты
Форум химиков
Как сделать «2М раствор»?
Как сделать «2М раствор»?
Сообщение AlexX » Ср дек 29, 2004 3:24 pm
Сообщение Satyros » Ср дек 29, 2004 3:59 pm
«2 М» раствор читается, как «двухмолярный раствор». Это значит, что на литр растворителя (воды) приходится два моля растворённого вещества.
Дальше считайте сами, мне лень. Чистая арихметика осталась.
Сообщение slavert » Ср дек 29, 2004 8:37 pm
Сообщение ИСН » Чт дек 30, 2004 12:54 am
Сообщение Леонид » Вт янв 04, 2005 12:27 am
Сообщение Bell » Пн янв 10, 2005 3:11 pm
Сообщение Borrel » Чт янв 13, 2005 7:52 pm
Сообщение slavert » Чт янв 13, 2005 8:23 pm
Сообщение Bell » Сб янв 15, 2005 10:16 pm
У нас, у танкистов спокон веков принято делать так:
Взять чистый сухой граненый стакан, взвесить на бытовых настольных весах и запомнить вес пустого стакана. Налить на треть раствор соляной кислоты и довести, приливая тонкой струйкой по лезвию ножа, до веса 100 г + вес стакана.
Потом вылить все в пол-литровую банку и долить ее дистиллированной водой почти до краев (ну разве что оставить 5 мм до края). Банку закрыть полУэтиленовой крышкой и поставить в надежное место.
В результате мы поимеем в своих крепких руках пол-литра 2М раствора HCl (с точностью +-5% или даже лучше)
Не, если у вас дома дохрена мерных цилиндров и таблиц плотности раствора HCl.
А мы, танкисты прекрасно обходимся без спецоборудования! Тока смекалка и находчивость!
Молярная концентрация
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Определите объем 2М соляной кислоты, израсходованной на взаимодействие с оксидом марганца (IV), если известно, что выделившийся
Ответ или решение 1
Данные: mI — масса вытесненного иода (mI = 25,4 г); раствор 2М (2 моль соляной кислоты на 1 л (1000 мл) воды).
Const: MI — молярная масса иода (MI ≈ 254 г/моль); MHCl — молярная масса соляной кислоты (MHCl ≈ 36,5 г/моль); ρHCl — плотность соляной кислоты (ρHCl = 1,19 г/см 3 = 1,19 г/мл).
1) Кол-во вещества иода: νI = mI / MI = 25,4 / 254 = 0,1 моль.
2) Ур-ние второй реакции: 2KI (иодид калия) + Cl2 (хлор) = 2KCl (хлорид калия) + I2 (иод).
3) Кол-во вещества хлора: νCl / νI = 1 / 1 и νCl = νI = 0,1 моль.
4) Ур-ние первой реакции: MnO2 (оксид марганца) + 4HCl (соляная кислота) = MnCl2 (хлорид марганца) + Cl2 ↑ (хлор) + 2Н2О (вода).
5) Кол-во вещества соляной кислоты: νHCl / νCl = 4 / 1 и νHCl = 4 * νCl = 4 * 0,1 = 0,4 моль.
6) Объем соляной кислоты: VHCl = Vр * νHCl / νр = 1000 * 0,4 / 2 = 200 мл.
Ответ: Израсходовали 200 мл соляной кислоты.
Определение концентрации веществ в растворах | Нормальность вещества
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
Массовую долю CdCl2 вычислим по формуле:
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
Теперь рассчитаем моляльность раствора:
Ответ: 53,3%; 6,22 моль/кг.