что такое антифибротический эффект
Антифибротическая терапия позволяет замедлить прогрессирование идиопатического легочного фиброза
Опубликованы результаты исследования INMARK. Лечение с использованием нинтеданиба в течение 12 недель по сравнению с плацебо не повлияло на степень изменения метаболита C-реактивного белка (СРБМ), но оказалось связано с замедлением скорости снижения форсированной жизненной емкости легких (ФЖЕЛ).
В журнале The Lancet Respiratory Medicine были опубликованы результаты рандомизированного двойного слепого исследования INMARK, в ходе которого оценивалась эффективность применения препарата Варгатеф (нинтеданиб) в сравнении с плацебо в течение 12 недель с последующим 40-недельным открытым исследованием при идиопатическом легочном фиброзе (ИЛФ). Это первое клиническое исследование, целью которого стала оценка прогностической значимости биомаркеров у пациентов с ИЛФ, получающих антифибротическую терапию (нинтеданиб). Результаты исследования показали, что даже у пациентов с сохранной функцией легких можно отметить разницу в скорости снижения форсированной жизненной емкости легких (ФЖЕЛ) при применении нинтеданиба и плацебо в течение 12 недель лечения.
ИЛФ – редкая и тяжелая патология легких, которой страдает около 3 млн человек по всему миру. Она вызывает прогрессирующий фиброз легких, который приводит к постоянному и необратимому ухудшению их функции и затруднению дыхания. В связи с непредсказуемостью течения ИЛФ и необратимостью ухудшения функции легких, специалисты считают, что лечение должно назначаться как можно раньше.
Варгатеф, ингибитор тирозинкиназы, относящийся к классу малых молекул, разработанный учеными компании «Берингер Ингельхайм», предназначен для лечения ИЛФ у взрослых пациентов. В 2015 году препарат был включен в обновленные международные клинические рекомендации по лечению ИЛФ. Он замедляет прогрессирование заболевания, на 50% замедляя ухудшение функции легких у различных категорий пациентов с ИЛФ. Препарат зарегистрирован для лечения пациентов с ИЛФ более чем в 70 странах.
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 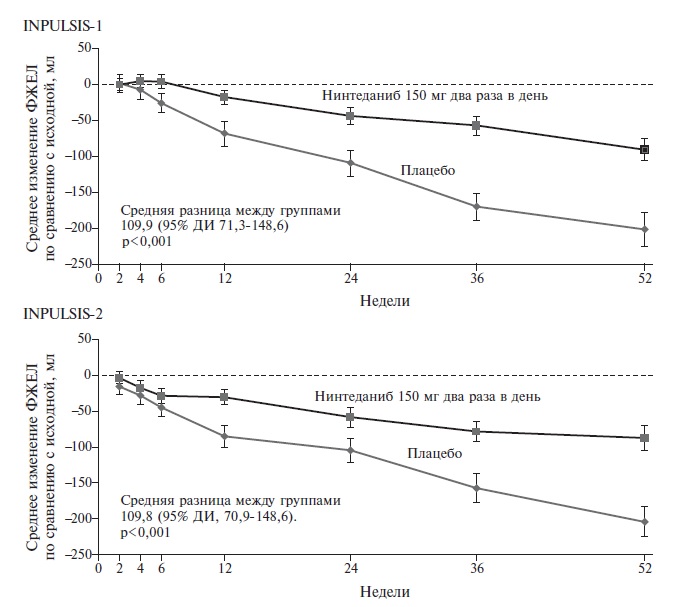
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
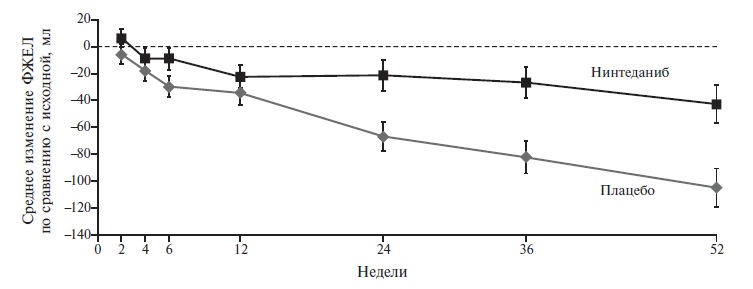
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
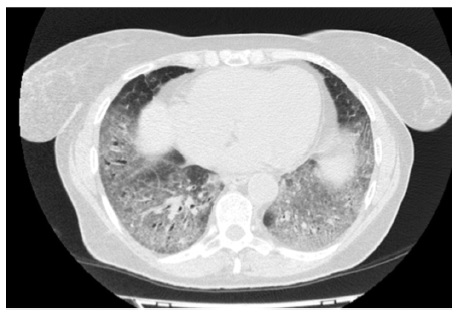
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.
В поиске идеального антифибротического препарата: как сказать «нет» фиброзу печени?

Согласно последним статистическим данным, около 0,1% жителей Европейского региона страдают ЦП, т. е. ежегодно диагностируется 14-26 новых случаев ЦП на 100 тыс. населения, а в течение года от этой патологии погибает 170 тыс. человек (Altamirano-Barrera А. et al., 2017). Ранее считалось, что фиброз печени сопровождается необратимым изменением структуры органа, но на протяжении последних нескольких лет накоплены убедительные данные доказательной медицины, подтверждающие обратимость процесса. К сожалению, в настоящее время речь не идет об обратном развитии прогрессирующего фиброза, а рассматривается возможность достижения положительной динамики в уменьшении стадии патологического процесса и инволюции начальных изменений при фиброзе печени. Выбор современных антифибротических препаратов невелик: только немногие лекарственные средства подтвердили свои антифибротические свойства в ходе рандомизированных контролированных исследований. Считается, что идеальный антифибротический препарат должен избирательно блокировать активность основного источника образования избыточного экстрацеллюлярного матрикса (ЭЦМ) – звездчатых клеток печени. В данном обзоре рассматриваются преимущества и недостатки существующих антифибротических лекарственных средств.
Немного патофизиологии

Ответ гепатоцитов на воспаление играет определяющую роль в патофизиологии фиброгенеза; активное участие в этом процессе принимают провоспалительные клетки, такие как моноциты и макрофаги. Активация макрофагов обусловливает выброс цитокинов и хемокинов, стимулирующих звездчатые клетки. Основным цитокином, активируемым макрофагами и обладающим профиброгенными свойствами, является трансформирующий фактор роста β (TGF-β): под его воздействием происходит превращение звездчатых клеток в миофибробласты (основной источник продукции ЭЦМ). Блокада рецепторов TGF-β приводит к ингибированию синтеза ЭЦМ и ускорению его деградации. В работе Friedman продемонстрирована основополагающая роль TGF-β в развитии фиброза печени и его инволюции при условии блокады действия этого цитокина.
Kluwe и соавт. (2010) подчеркивают роль c-Jun N-терминальной киназы (JNK) в воспалительном повреждении печени: в экспериментальных условиях введение антагонистов указанного фермента сопровождалось уменьшением прогрессирования фиброза.

Изучение и понимание сложных механизмов формирования фиброза и ЦП позволили разработать эффективные терапевтические мероприятия, направленные на профилактику, предотвращение прогрессирования / обратное развитие фиброза и улучшение функции печени.
В настоящее время количество препаратов, обладающих доказанным выраженным антифибротическим действием, невелико. Поэтому лекарственные средства, способные противодействовать формированию фиброза, чрезвычайно ценятся гастроэнтерологами.
Препараты с антифибротическими свойствами
Терапию, направленную на подавление развития и сдерживание прогрессирования фиброза, подразделяют на несколько направлений, предполагающих:
Считается, что идеальный антифибротический препарат должен обладать всеми вышеперечисленными свойствами.
Наиболее эффективным способом профилактики формирования фиброза является исключение воздействия повреждающих факторов, но, к сожалению, это не всегда возможно. Несмотря на успешное применение новых противовирусных препаратов прямого действия и достижение устойчивого вирусологического ответа, у многих пациентов продолжают обнаруживать гистологические признаки фиброза и ЦП. Сохраняющиеся явления ЦП означают, что риск развития осложнений, свойственных данному заболеванию (портальная гипертензия, печеночная энцефалопатия, желудочно-кишечные кровотечения, печеночная недостаточность, спонтанный бактериальный перитонит, гепаторенальный синдром, ГЦК), остается чрезвычайно высоким. В случаях, когда поражение печени имеет невирусную этиологию, полностью исключить воздействие этиологических факторов не всегда удается. Поэтому наряду с устранением основных причин, приведших к заболеванию печени, применяют препараты патогенетической направленности, препятствующие развитию и прогрессированию воспаления, оксидативного стресса и фиброгенеза.
Кортикостероиды
В лечении различных заболеваний печени используются кортикостероиды (КС). Применение лекарственных средств этой фармакологической группы позволяет улучшить гистологическую картину печени у больных АИГ. А. Czaja и соавт. (2004) сообщили об уменьшении выраженности фиброза печени на 53% у пациентов, получавших КС на протяжении 57±7 месяцев. Исследователи также отметили снижение гистологической активности заболевания при применении КС по сравнению с плацебо (61 vs 32%; р=0,02). Молекулярные механизмы, посредством которых КС оказывают антифибротическое действие при АИГ, были относительно недавно описаны А. Montano-Loza и соавт. (2016): КС ограничивают повреждение печени, уменьшают молекулярные сигналы, направленные на активацию фиброгенеза, облегчают деградацию ЭЦМ. Однако большой спектр клинически значимых побочных действий, свойственных КС, существенно ограничивает возможность применения этих медикаментов в качестве антифибротических средств.
Урсодезоксихолевая (УДХК) и хенодезоксихолевая (ХДХК) кислоты
Доказано, что УДХК обладает некоторой противофибротической активностью: ее применение при первичном билиарном циррозе (в соответствии с новой терминологией – первичный билиарный холангит, ПБХ) способствует уменьшению клинических проявлений заболевания и замедлению прогрессирования фиброза печени. В работе Corpechot и коллег (2000) установлено, что терапия УДХК ассоциируется с 5-кратным снижением скорости прогрессирования ПБХ с начальных стадий заболевания до выраженного фиброза и ЦП (7% в год при использовании УДХК vs 34% при применении плацебо; р Особенности действия
Чем же глицирризин (гликозид, получаемый из корня солодки) заслужил такое привилегированное положение? Оказывается, он обладает выраженными противовоспалительными и антиаллергическими свойствами, имеет гепатопротекторное, антифибротическое, антиоксидантное, противоапоптотическое, антиканцерогенное, противовирусное и иммунорегуляторное действие. Противовоспалительную активность этого препарата объясняют особенностями структурного строения глицирризина (сходство молекул глицирризина и кортизола), за счет чего ему удается ингибировать ключевые ферменты метаболизма КС: 11-β- и 20-β-оксистероиддегидрогеназу, 5-β-редуктазу, что приводит к замедлению превращения кортизола в его неактивную форму, а также к увеличению концентрации эндогенного кортизола в крови. Глицирризин способен ингибировать ферменты, расщепляющие КС, поэтому его противовоспалительные свойства называют еще псевдокортикостероидным эффектом.
В экспериментальных исследованиях с участием лабораторных животных доказано, что глицирризин снижает экспрессию мРНК SMAD2 и SMAD3, уменьшает отложение коллагена в печени и активность фиброгенеза (Qu Y. et al., 2015). Эти же авторы в своей более ранней работе продемонстрировали замедление активации и пролиферации звездчатых клеток, усиление их апоптоза посредством транслокации NF-κB под воздействием глицирризина (Qu Y. et al., 2012). Антифибротические свойства глицирризина подтверждены еще в целом ряде исследований, проведенных на лабораторных животных (мыши, крысы): Х. Zhao и коллеги (2013) установили, что глицирризин препятствует развитию портальной гипертензии, а Т. Moro и соавт. (2008) зафиксировали ингибирование SMAD-опосредованной транскрипции гена коллагена I типа. Необходимо отметить, что глицирризин обладает еще одной уникальной способностью – он активирует коллагеназы, вызывающие дегрануляцию уже сформированного избыточного количества коллагена в ЭЦМ, способствуя тем самым обратному развитию фиброза.
Доказана способность глицирризина ингибировать апоптоз и некроз гепатоцитов посредством супрессии фактора некроза опухоли (ФНО) и каспазы-3. Это мнение полностью разделяют В. Liang и соавт. (2015), Х. Guo и коллеги (2013): ученые подтвердили наличие у препарата антиапоптотических свойств, позволяющих ему эффективно защищать гепатоциты и препятствовать развитию фиброза.
Еще одной немаловажной особенностью действия глицирризина является его иммуномодулирующая активность: в зависимости от исходного состояния иммунной системы препарат оказывает иммуностимулирующее или иммуносупрессивное действие. С. Tu и соавт. (2012) показали, что глицирризин предупреждал развитие воспалительного процесса в печени и формирование фиброза: он ингибировал инфильтрацию паренхимы печени Т-хелперами 1 типа, Th2, Th17, а также регулировал баланс Th1/Th2 и Treg/Th17. Ученые объяснили выявленные свойства препарата воздействием на JNK, ERK и PI3K/AKT-зависимые пути.
Мягкая противовирусная активность, способность усиливать некоторые иммунные функции (продукцию интерферона (ИФН), активность NK) и модулировать реакции роста лимфоцитов путем повышения синтеза интерлейкина-2 являются дополнительными преимуществами глицирризина.
Клиническое применение
Фармакологическая композиция, используемая для парентерального лечения различных хронических заболеваний печени, содержит 0,2% глицирризина, 2% глицина, 0,1% цистеина, физиологический раствор; форма выпуска для перорального приема вместо цистеина включает другую S-содержащую аминокислоту – метионин. Раствор глицирризина, предназначенный для парентерального применения, вводят в периферическую вену на протяжении 3-5 минут при этом пациенты могут лечиться амбулаторно.
В целом ряде исследований показано достоверное снижение уровня аланинаминотрансферазы (АЛТ) у пациентов с ХВГ, НАЖБП. Однако при различных заболеваниях используются разные дозы и схемы введения препарата. Например, Т. van Rossum и соавт. (2001) выполнили двойное слепое рандомизированное плацебо-контролированное исследование, рекомендуя больным хроническим гепатитом С, которые не ответили на противовирусную терапию ИФН (n=57), принимать 80, 160, 240 мг глицирризина или плацебо. Исследуемые препараты вводили внутривенно (в/в) 3 р/нед на протяжении 4 недель. Среднее снижение уровня АЛТ в конце исследования на фоне приема глицирризина было на 26% больше, чем в группе плацебо (6%). Эффективность терапии различными дозами глицирризина оказалась сопоставимой между группами.
В другом исследовании, имевшем подобный дизайн по подбору пациентов и выполненном этой же группой ученых, сравнивалась эффективность различных схем введения препарата: глицирризин назначали в одинаковой дозе, но вводили 3 р/нед или 6 р/нед на протяжении 4 недель. Среднее снижение АЛТ по сравнению с исходными значениями составило 26% при приеме препарата 3 р/нед и 47% при введении его 6 р/нед (в обоих случаях р Медична газета «Здоров’я України 21 сторіччя» № 24 (421), грудень 2017 р.
СТАТТІ ЗА ТЕМОЮ
28-30 жовтня в м. Києві відбулася науково-практична конференція з міжнародною участю «Рефракційний пленер – 2021». Програма заходу була надзвичайно багатогранною й охоплювала весь спектр офтальмологічних патологічних станів від поверхневого кератиту до пухлин орбітальної ділянки. Серед окремих секцій і тематичних блоків було представлено сателітний симпозіум компанії Alcon, у ході якого провідні українські та закордонні офтальмологи обговорили питання сухого ока, оптимальної контактної корекції зору та застосування сучасних сльозозамінників.
Пандемія коронавірусної хвороби (COVID‑19) є загрозою для громадського здоров’я в усьому світі. Високі показники госпіталізації пов’язані з відсутністю специфічної противірусної терапії на ранніх етапах захворювання. Цьому й іншим питанням була присвячена науково-практична конференція з міжнародною участю «Нові стратегії лікування COVID‑19», яка відбулася 29 жовтня під егідою АТ «Фармак».