что такое азеотропная смесь
АЗЕОТРОПНЫЕ СМЕСИ
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) (от греч. а—приставка, означающая отрицание или отсутствие к.-л. свойства,
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах. Нек-рые в-ва особенно склонны к образованию азеотропных смесей, особенно с представителями к.-л. одного го-мологич. ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из разл. рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с азеотропными смесями, что составляет примерно половину всех изученных смесей. Поэтому изучение св-в систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии. Такие сведения особенно важны для хим. и нефтехим. отраслей пром-сти, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с азеотропными смесями, а технол. процессы часто проводятся при повыш. т-рах и давлениях, т.е. вблизи критич. параметров и в закритич. области.
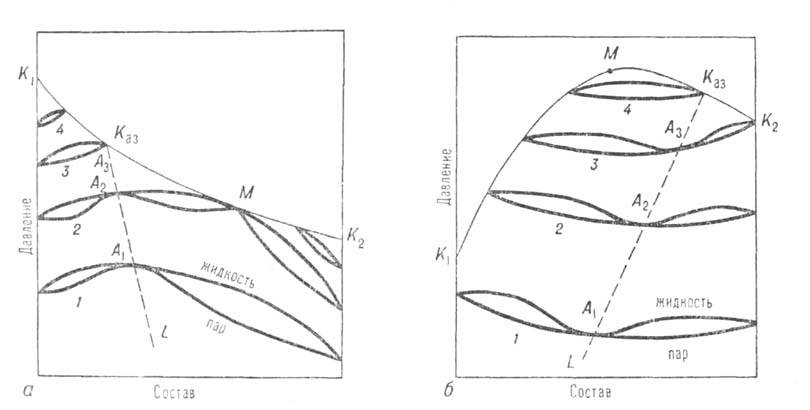
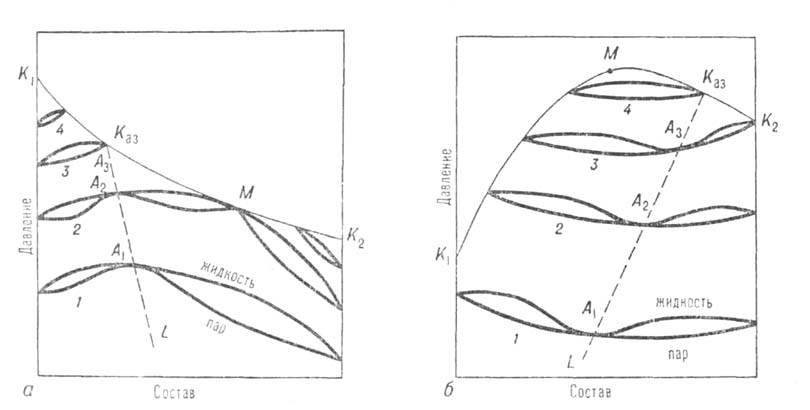
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной т-ре (изотермы общего давления) имеют максимумы или минимумы (точки А1, А2, А3 на рис. 1). Соответственно на изобарах т-р кипения в этих точках имеются минимумы или максимумы (см. Коновалова законы). При максимуме на изотерме (минимуме на изобаре) азеотроп наз. положительным, при минимуме на изотерме (максимуме на изобаре)-отрицательным. Среди двойных систем с азеотропными смесями примерно 93% приходится на системы с положит. азеотропами. Известны случаи существования в одной системе двух азеотропов разного знака при S-образной изобаре т-р кипения (напр., в системе фторбензол-бензол).
Азеотропные смеси возникают вследствие отклонения поведения системы от поведения, свойственного идеальным р-рам. Названия «положительный» и «отрицательный» азеотроп соответствуют положит. и отрицат. отклонениям от идеальности. Азеотропные смеси могут образовываться даже при весьма малых отклонениях от идеальности, если изобарич. т-ры кипения обоих компонентов близки между собой. В этих случаях составы азеотропных смесей обычно ближе к эквимолярным, чем при значит. различии т-р кипения компонентов, когда азеотропные смеси могут располагаться и на концах концентрац. интервала системы, вблизи чистых компонентов. При составе, близком к 100% одного из компонентов, азеотроп наз. тангенциальным или почти тангенциальным.
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; Каз-критич. точка азеотропа; ЦСаз-линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критич. кривой, соотв. К1КазМК2 и К1МКазК2.
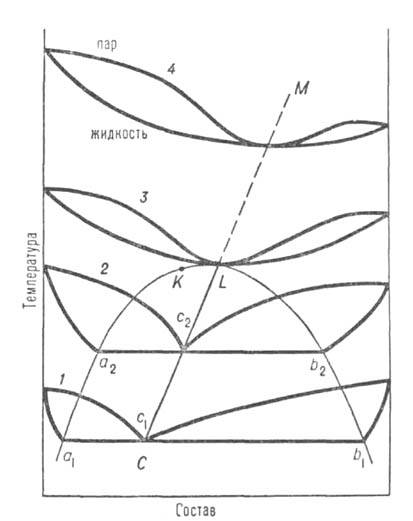
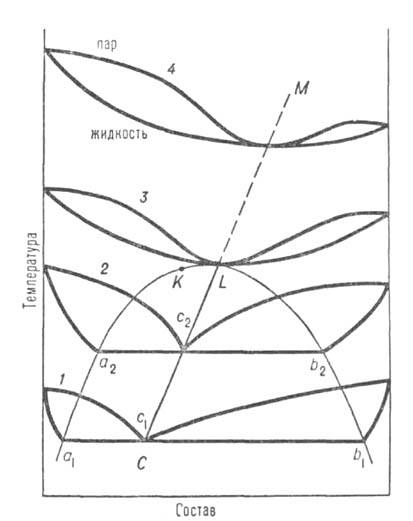
Рис. 2. Диаграмма равновесия жидкость-пар в системе с расслаивающейся жидкой смесью; аКb-пограничная кривая равновесия двух жидких фаз; кривые 1-4-изобары равновесия; c1, с2-составы пара, равновесного двум жидким фазам a1b1 и а2b2; CL-линия гетероазеотропов.
Общих методов, позволяющих предсказать возможность образования в данной системе азеотропной смеси и ее параметры (состав, т-ру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
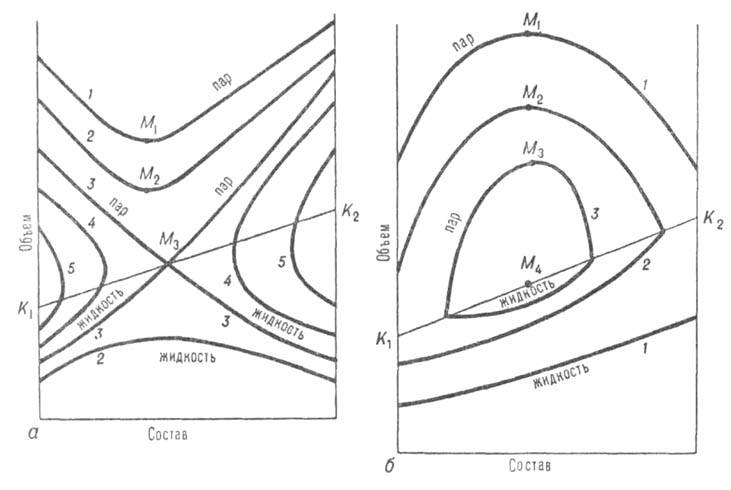
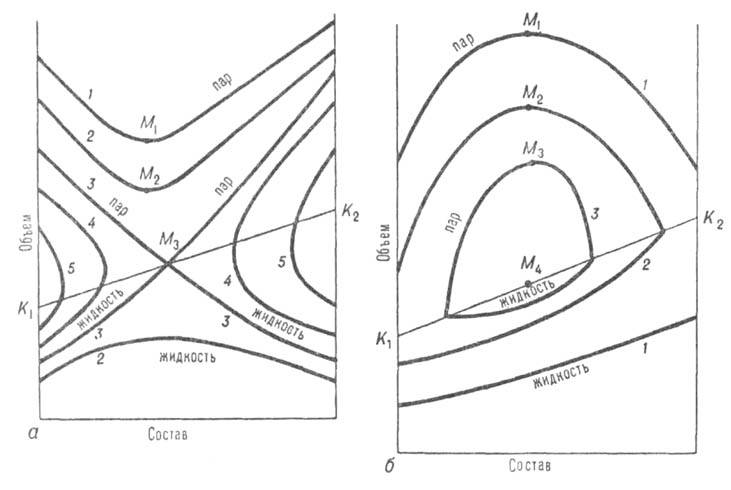
Отличит. черты систем с азеотропизмом не исчерпываются существованием в них азеотропной смеси, главная особенность к-рой состоит в том, что в термодинамич. отношении она ведет себя как чистое в-во независимо от числа компонентов. Наличие азеотропной смеси оказывает влияние на св-ва системы и за пределами существования азеотропной смеси. Особенно отчетливо это проявляется в объемном поведении системы. Из-за того что на изотермах общего давления пара имеются экстремумы, изотерма объема для паровой фазы обязательно имеет минимум у систем с положит. азеотропом и максимум у систем с отрицат. азеотропом (точки M1,М2, М3 на рис. 3). При этом составы, соответствующие экстремумам, вследствие неидеальности паровой фазы не совпадают с составами азеотропных смесей. При положит. азеотропе критич. состояние достигается сначала для смеси и на критич. кривой появляется температурный минимум, в к-ром равновесие жидкость-пар распадается на две области (точка М3 на рис. 3, а). В одной из них в нек-ром интервале т-р еще сохраняется азеотропная смесь; точка соприкосновения линии азеотропов с критич. кривой наз. критич. точкой азеотропа Каз (рис. 1, а). С повышением т-ры эти области постепенно уменьшаются, стягиваясь к критич. точкам чистых компонентов. При отрицат. азеотропе область равновесия жидкость-пар сохраняется при т-рах выше критич. т-р чистых компонентов, располагаясь в средней части концентрац. интервала (рис. 1, б и 3, б). При дальнейшем повышении т-ры эта область стягивается в точку, отвечающую максимуму т-ры на критич. кривой (точки М на рис. 3, б).
Рис. 3. Диаграммы равновесия жидкость-пар в координатах объем-состав для двойной системы с положит. (а) и отрицат. (6) азеотропами; 1-5-изотермы равновесия жидкой и паровой фаз; М1, М2, M3-минимумы (а) и максимумы (б) на изотерме паровой фазы; изотерма 3 соответствует температурному минимуму М3(а) и температурному максимуму М4(б) на критич. кривой, соотв. K1M3K2 и К1М4К2.
Термодинамич. поведение систем с азеотропными смесями резко отличается от поведения простых систем и в закритич. области. Зависимости объема, энтальпии и энтропии газовой смеси от состава при постоянных т-ре и давлении (изотермы-изобары) при составе, близком к Каз, имеют точки перегиба с вертикальной касательной. Значения этих величин изменяются с концентрацией очень сильно. Так, в системе аммиак-этан мольный объем газовой смеси при ничтожном изменении состава возрастает почти вдвое. Изотермы-изобары вышеуказанных величин проходят, кроме того, через резко выраженные максимумы. Эти и др. особенности систем с азеотропными смесями распространяются на значит. интервал т-р и давлений в закритич. области. Поэтому использование ур-ний состояния, применяемых обычно к газовым смесям в области невысоких т-р и давлений, невозможно, если нет сведений о наличии (или отсутствии) в данной системе азеотропной смеси и о пределах ее существования.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии азеотропных смесей в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах азеотропных смесей, причем вероятность появления тройного азеотропа тем больше, чем больше число азеотропных смесей в двойных системах.
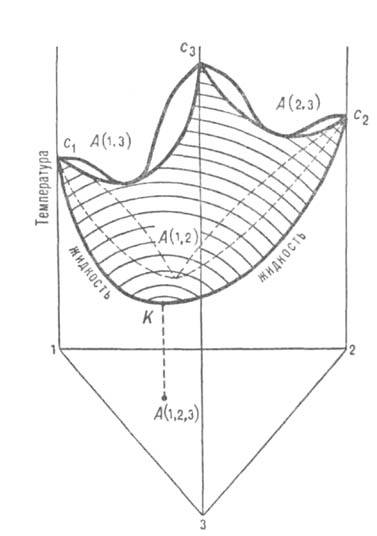
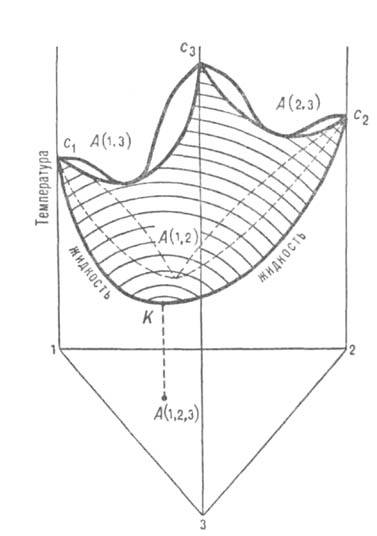
В тройных системах встречаются три типа азеотропных смесей. Положит. азеотроп характеризуется максимумом на изотермич. повети давления пара (соотв. минимумом на изобарич. пов-сти т-р кипения) в треугольной диаграмме равновесия (рис. 4). Эта диаграмма показывает зависимость концентраций компонентов, при к-рых имеется равновесие жидкость-пар, от т-ры (при постоянном давлении) или давления (при постоянной т-ре). Составы тройной системы представлены концентрац. треугольником. Изобарич. пов-сть с1А (1,2)с2А (2,3)с3А (1,3)К для равновесных жидких фаз имеет тройную азеотропную смесь в точке К. Концентрация азеотропной смеси соответствует точке А (1,2,3) на треугольнике составов. Положит. азеотропная смесь образуется в тех случаях, когда в исходных двойных системах имеются только положит. азеотропы [на рис. 4 каждая двойная система имеет азеотропы в точках А (1,2), А (2,3), А (1,3)]. Отрицат. азеотропная смесь образуется, когда в системе имеются только отрицат. двойные азеотропы. Ей соответствует минимум на изотермич. повети общего давления (максимум на изобарич. пов-сти т-р кипения).
Рис. 4. Диаграмма равновесия жидкость-пар в системе с тройным положительным азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарич. пов-сть равновесной жидкой фазы.
Составы тройных азеотропных смесей изменяются с т-рой (давлением). Соответствующая зависимость изображается пространств. кривой в изобарич. (изотермич.) призме. Кривая может доходить до критич. пов-сти системы, отграничивающей область существования двухфазного равновесия жидкость-пар, но может заканчиваться и ранее. Объемное поведение тройных систем очень сложно. Оно определяется не только наличием тройного азеотропа и его типом, но и типами двойных азеотропных смесей в исходных системах, поскольку обусловленные последними особенности св-в не исчезают скачком с прибавлением третьего компонента.
Эксперим. исследования систем с тройными азеотропными смесями очень трудоемки. Поэтому большую роль здесь играют теоретич. представления о возможных видах диаграмм состояния. Широко используется для этого правило азеотропии, к-рое качественно связывает кол-во и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарич. поверхности т-р кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
===
Исп. литература для статьи «АЗЕОТРОПНЫЕ СМЕСИ» : Свентославский В., Азеотропия и полиазеотропия, пер. с англ., М., 1968; Огородников С.К., Лестева Т.М., Коган В. Б., Азеотропные смеси. Справочник, Л., 1971; Маленко Ю.И., Молодснко П. Я., Диаграммы трехкомпонентных азеотропных систем, Л., 1975; Казакова Н. Е., Системы с азеотропизмом при высоких давлениях, М., 1978; Хазанова Н. Е., Соминская Е.Э., Захарова А.В., «Ж. физ. химии», 1981, т. 55, № 10, с. 2640-42. Н. Е. Хазанова.
Страница «АЗЕОТРОПНЫЕ СМЕСИ» подготовлена по материалам химической энциклопедии.
Что такое азеотроп со спиртом и чем он важен самогонщику
Иногда на форумах можно встретить загадочное слово “азеотроп” или сочетание “точка азеотропа”. Это понятие пришло в самогоноварение из химии и промышленной дистилляции и относится к “чистому” спирту” крепостью более 97%. Что за зверь этот азеотроп и зачем его нужно знать самогонщику — разбираемся вместе.
Что такое азеотроп?
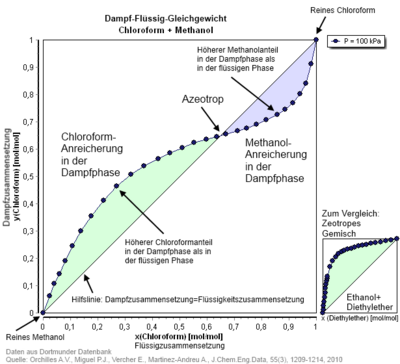
Азеотроп — это нераздельнокипящая смесь двух и более жидкостей. Каждая из жидкостей азеотропа при стабильном атмосферном давлении образует пар и конденсат того же состава, что и она сама. Азеотроп не обязательно постоянен, чаще есть точка (точки) азеотропа, в которой совпадают все условия для неизменности состава смеси. Поэтому азеотроп обычно описывают графиком:
Зачем самогонщику точка азеотропа?
У азеотропа спирта с водой тоже есть точка — 97,17% объемных долей спирта. Точка азеотропа во время перегонки наступает при температуре 78,1оС и нормальном атмосферном давлении. До этой точки и температуры спирт с водой кипит и пары обогащаются спиртом более, чем водой. После этой точки — менее. Иначе говоря, точка азеотропа связана с конечной точкой перегонки — нет смысла разделять спирт на фракции после точки азеотропа. Здесь надо сказать, что на бытовом оборудовании получить спирт крепче 97,1% не получится вообще. Более крепкий спирт можно получить только если использовать эпюрацию, снизить атмосферное давление, либо обезводить состав, например — обезвоженным медным купоросом (но после купороса пить его будет нельзя).
Кстати, наиболее близко к спирту крепостью выше 97,17% и точке азеотропа можно подойти, используя колонну с высокоэффективной спирально-призматической насадкой (СПН). Благодаря огромной площади контакта СПН дает максимально возможное при атмосферном давлении укрепление и разделение спирта. Такая насадка используется во многих современных аппаратах, например — в Люкссталь 8m.
Азеотропная смесь
Азеотропная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз.
При изменении давления изменяется не только температура кипения, но и состав азеотропной смеси, этим они отличаются от чистых жидкостей.
Для разделения азеотропных смесей используют различные технологии:
См. также
Примечания
Полезное
Смотреть что такое «Азеотропная смесь» в других словарях:
АЗЕОТРОПНАЯ СМЕСЬ — (от a отрицательная приставка zeo киплю и trope поворот, изменение), жидкая смесь, которая при данном давлении не разделяется на компоненты путем перегонки. Напр., 96% ный водный раствор этилового спирта (спирт ректификат) перегонкой при… … Большой Энциклопедический словарь
азеотропная смесь — азеотропная смесь; отрасл. нераздельно кипящая смесь Раствор, образующий при равновесии пар того же состава … Политехнический терминологический толковый словарь
азеотропная смесь — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN azeotropic mixture … Справочник технического переводчика
азеотропная смесь — (от а. отрицательная приставка, zéō киплю и tropē поворот, изменение), жидкая смесь, которая при данном давлении не разделяется на компоненты путём перегонки. Например, 96% ный водный раствор этилового спирта (спирт ректификат) перегонкой… … Энциклопедический словарь
азеотропная смесь — azeotropinis mišinys statusas T sritis chemija apibrėžtis Skystasis mišinys, kurio distiliavimu esant tam pačiam slėgiui negalima perskirti į atskirus komponentus. atitikmenys: angl. azeotrope; azeotropic mixture; constant boiling mixture rus.… … Chemijos terminų aiškinamasis žodynas
Азеотропная смесь — (от а отрицательная частица, греческое zéō киплю и tropē поворот, изменение) нераздельно кипящая смесь; однородная жидкая смесь (См. Жидкие смеси), которая при перегонке не разделяется на фракции. Существование А. с. открыто в 1810 Дж.… … Большая советская энциклопедия
азеотропная смесь — (а. + гр. zed киплю + trope изменение) нераздельнокипящая смесь; однородная смесь двух или нескольких жидкостей, которая при перегонке не разделяется на фракции; около 50% жидких смесей промышленного значения образуют азеотропные смеси. Новый… … Словарь иностранных слов русского языка
АЗЕОТРОПНАЯ СМЕСЬ — (от а отрицат. приставка, zeo киплю и trope поворот, изменение), жидкая смесь, к рая при данном давлении не разделяется на компоненты путём перегонки. Напр., 96% ный вод. р р этилового спирта (спирт ректификат) перегонкой при норм. давлении… … Естествознание. Энциклопедический словарь
Азеотропная смесь — холод. техн. Смесь жидкостей, жидкая и газообразная фазы которой в условиях термодинамического равновесия имеют один и тот же состав. Температура кипения смеси постоянна … Универсальный дополнительный практический толковый словарь И. Мостицкого
азеотропная смесь — нераздельнокипящая смесь … Cловарь химических синонимов I
главная > справочник > химическая энциклопедия:
Азеотропные смеси
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах. Некоторые вещества особенно склонны к образованию азеотропных смесей, особенно с представителями какого-либо одного гомологического ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из различных рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрационный интервал.
Известно ок. 10 000 систем с азеотропных смесей, что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и критическом состоянии. Такие сведения особенно важны для химической и нефтехимической отраслей промышленности, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с азеотропными смесями, а технологические процессы часто проводятся при повышенных температурах и давлениях. т.е. вблизи критических параметров и в закритической области.
Азеотропные смеси возникают вследствие отклонения поведения системы от поведения, свойственного идеальным растворам. Названия «положительный» и «отрицательный» азеотроп соответствуют положительным и отрицательным отклонениям от идеальности. Азеотропные смеси могут образовываться даже при весьма малых отклонениях от идеальности, если изобарические температуры кипения обоих компонентов близки между собой. В этих случаях составы азеотропные смеси обычно ближе к эквимолярным, чем при значительном различии температур кипения компонентов, когда азеотропные смеси могут располагаться и на концах концентрационного интервала системы, вблизи чистых компонентов. При составе, близком к 100% одного из компонентов, азеотроп называют тангенциальным или почти тангенциальным.
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положительным (а) и отрицательным (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; Каз-критическая точка азеотропа; ЦСаз-линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критической кривой, соответственно К1КазМК2 и К1МКазК2.
Общих методов, позволяющих предсказать возможность образования в данной системе азеотропной смеси и ее параметры (состав, температуру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
Рис. 3. Диаграммы равновесия жидкость-пар в координатах объем-состав для двойной системы с положительным (а) и отрицательным (6) азеотропами; 1-5-изотермы равновесия жидкой и паровой фаз; М1, М2, M3-минимумы (а) и максимумы (б) на изотерме паровой фазы; изотерма 3 соответствует температурному минимуму М3(а) и температурному максимуму М4(б) на критической кривой, соответствующей K1M3K2 и К1М4К2.
Термодинамическое поведение систем с азеотропные смеси резко отличается от поведения простых систем и в закритической области. Зависимости объема, энтальпии и энтропии газовой смеси от состава при постоянных температуре и давлении (изотермы-изобары) при составе, близком к Каз, имеют точки перегиба с вертикальной касательной. Значения этих величин изменяются с концентрацией очень сильно. Так, в системе аммиак-этан мольный объем газовой смеси при ничтожном изменении состава возрастает почти вдвое. Изотермы-изобары вышеуказанных величин проходят, кроме того, через резко выраженные максимумы. Эти и др. особенности систем с азеотропные смеси распространяются на значит. интервал температур и давлений в закритической области. Поэтому использование уравнений состояния, применяемых обычно к газовым смесям в области невысоких температур и давлений, невозможно, если нет сведений о наличии (или отсутствии) в данной системе азеотропные смеси и о пределах ее существования.
В тройных системах встречаются три типа азеотропные смеси Положительный азеотроп характеризуется максимумом на изотермической поверхности давления пара (соответствует минимумом на изобарической поверхности температур кипения) в треугольной диаграмме равновесия (рис. 4). Эта диаграмма показывает зависимость концентраций компонентов, при которых имеется равновесие жидкость-пар, от температуры (при постоянном давлении) или давления (при постоянной температуре). Составы тройной системы представлены концентрационным треугольником. Изобарическая поверхность с1А (1,2)с2А (2,3)с3А (1,3)К для равновесных жидких фаз имеет тройную азеотропные смеси в точке К. Концентрация азеотропные смеси соответствует точке А (1,2,3) на треугольнике составов. Положительные азеотропные смеси образуется в тех случаях, когда в исходных двойных системах имеются только положительные азеотропы [на рис. 4 каждая двойная система имеет азеотропы в точках А (1,2), А (2,3), А (1,3)]. Отрицательные азеотропные смеси образуется, когда в системе имеются только отрицательные двойные азеотропы. Ей соответствует минимум на изотермической поверхности общего давления (максимум на изобарической поверхности температур кипения).
Рис. 4. Диаграмма равновесия жидкость-пар в системе с тройным положительным азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2,3), А(1, 3). Заштрихована изобарическая поверхность равновесной жидкой фазы.
Составы тройных азеотропные смеси изменяются с температурой (давлением). Соответствующая зависимость изображается пространственной кривой в изобарической (изотермической) призме. Кривая может доходить до критической поверхности системы, отграничивающей область существования двухфазного равновесия жидкость-пар, но может заканчиваться и ранее. Объемное поведение тройных систем очень сложно. Оно определяется не только наличием тройного азеотропа и его типом, но и типами двойных азеотропных смесей в исходных системах, поскольку обусловленные последними особенности свойства не исчезают скачком с прибавлением третьего компонента.
Экспериментальные исследования систем с тройными азеотропные смеси очень трудоемки. Поэтому большую роль здесь играют теоретические представления о возможных видах диаграмм состояния. Широко используется для этого правило азеотропии, которое качественно связывает количество и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарической поверхности температур кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
Азеотроп
Оглавление
Физический фон
Типы азеотропов
Минимальное давление или максимальное давление
Есть два разных типа азеотропов:
Максимальное давление азеотропа хлороформ / метанол
P, x, y диаграмма, T = 20 ° C
Минимальное давление азеотропа
2-бутанон / 1,2-дихлорэтан
P, x, y диаграмма, T = 60 ° C
Гетероазеотроп или гомогенный азеотроп
Равновесие жидкость-жидкость
/ 1-пентанол
Равновесие пара-жидкости
вода-этанол-бензол
В случае гетероазеотропа жидкость и пар не имеют одинакового состава, поскольку в случае азеотропного состава жидкая фаза нестабильна и распадается на две фазы. Это свойство используется, например, при азеотропной ректификации для разделения азеотропной смеси с помощью сепаратора жидкость-жидкость.
Седло азеотропа
Седловой азеотроп встречается только в тройных и более высоких смесях. Он характеризуется тем, что тройной (или более высокий) азеотроп находится между точками кипения чистых веществ и, таким образом, не образует ни максимума давления, ни минимума давления азеотропа.
| Т / К | P / кПа | х ацетон | х хлороформ | х метанол | источник |
|---|---|---|---|---|---|
| 331,02 | 101,325 | 0,316 | 0,238 | 0,446 |
Термин «седловидный азеотроп» происходит непосредственно от формы трехмерно нарисованного равновесия пар-жидкость.
Процессы физического разделения азеотропов
Азеотропная ректификация
Когда смесь этанола и воды перегоняют несколько раз, получается азеотроп из примерно 96% этанола и 4% воды, который не может быть далее разделен дистилляцией и который кипит при 78,17 ° C.
Однако этот азеотроп можно отделить, добавив третий компонент. При добавлении бензола смесь воды и этанола образует азеотроп с тремя компонентами ( тройной азеотроп ), который кипит при 64,9 ° C. Эта смесь вода-бензол-этанол теперь может быть отогнана, и вода, таким образом, может постепенно вытягиваться из жидкой фазы. Остается смесь бензола и этанола, от которой бензол можно отделить обычной перегонкой, чтобы получить безводный этанол.
Паропроницаемость и первапорация
В отличие от паропроницаемости, при первапорации жидкая смесь проходит через мембрану.