что такое high grade в онкологии
Стадирование рака
Правильное и эффективное лечение рака напрямую зависит не только от определения его типа, но и от сведений о размере опухоли и степени ее распространения.
Для систематизации такой информации во всем мире принято использовать международную классификацию стадий злокачественных новообразований TNM.
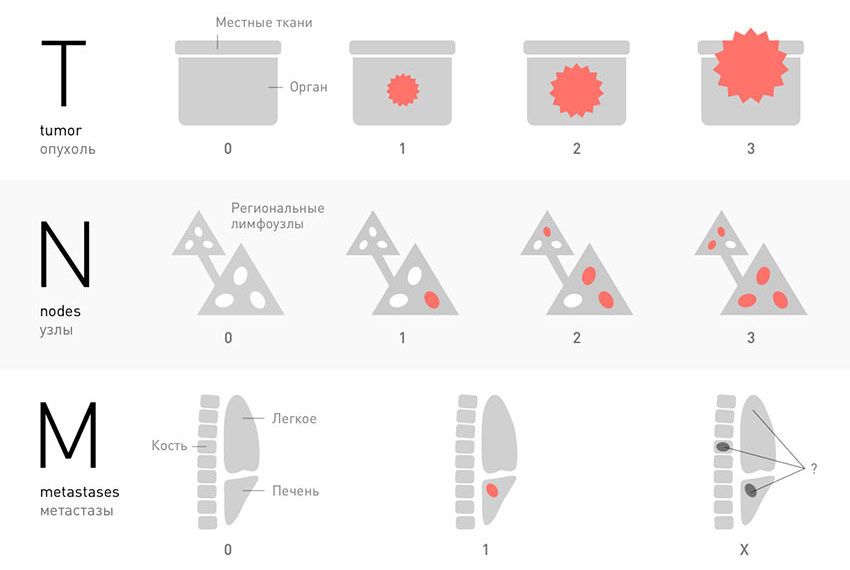
Классификация TNM основана на трех факторах: размер первичной опухоли (T — tumor), вовлеченность регионарных лимфатических узлов (N — nodes) и наличие отдаленных метастазов (M — metastasis). Для каждого вида рака существует своя градация, это определяет подход к лечению, а также прогноз.
Например, для рака молочной железы показатель T определяет диаметр первичной опухоли и ее взаимодействие с окружающими тканями. Опухоль с показателями Т1-Т3, ограниченная молочной железой, определяется размером, а T4, независимо от размера, предполагает распространение опухоли на кожу или грудную стенку. В то же время, для меланомы показатель Т определяется только глубиной прорастания опухоли (инвазия до 1 мм — Т1, а более 4 мм — Т4).
Показатель N для разных опухолей тоже разный, включая количество лимфатических узлов, их размеры, выход за предел капсулы лимфатического узла и т. д. N описывает только регионарные лимфатические узлы, которые отличны для каждой конкретной опухоли. Например, для рака печени лимфатические узлы вдоль ворот печени являются регионарными — ближайшими лимфатическими узлами, собирающими лимфу от области опухоли. Но, в то же время, расположенные рядом мезентериальные или забрюшинные лимфатические узлы, уже не являются регионарными для данной опухоли, а значит, определяются как отдаленные метастазы (М).
Ранее для каждого типа рака стадия определялась взаимоотношением этих трех параметров, но со временем, по мере изучения биологии рака и механизмов развития опухолей, параметров становилось все больше. Сейчас во всем мире используют классификации 8-го пересмотра, которые каждые 5-7 лет выпускают две организации: The Union for International Cancer Control (UICC) и The American Joint Committee on Cancer (AJCC).
Сегодня стадия может быть клинической (с), когда перед операцией мы определяем ее по данным диагностических исследований. Например, при раннем раке молочной железы стадия может выглядеть так — cT2N0M0. А после операции, когда весь материал был подвергнут полноценному гистологическому исследованию, выставляется патоморфологический диагноз (р), и этот же случай может быть рестадирован в pT2pN2а (5/12) M0. Это означает, что клинически неопределяемые метастазы в подмышечных лимфатических узлах были выявлены в 5 из 12 удаленных и исследованных лимфатических узлах.
Существуют и другие нюансы, возьмем, к примеру, стадирование после проведенной неоадьювантной (предоперационной) химиотерапии (префикс yp), когда у женщины с местнораспространенным раком молочной железы сT3N1M0 лечение начали с химиотерапии, а после провели операцию и увидели, что все опухолевые клетки погибли от химиотерапевтического лечения. Это означает, что у данной женщины полный лечебный патоморфоз, а стадироваться эта ситуация будет так — ypT0ypN0, CR.
Помимо TNM, используются также следующие символы:
Стадия может зависеть даже от того, определяется ли в опухолевой ткани вирус папилломы человека (p16), как это происходит в случае с раком ротоглотки.
Не все параметры используются для каждой опухоли, но процесс стадирования становится все сложнее. Этим мы обязаны прогрессу в лечении и большим данным, диктующим необходимость все более разных подходов для разных стадий.
Стадия также определяет прогноз, хотя и здесь подходы сегодня пересматриваются. Благодаря иммунотерапии, многие (ранее «безнадежные») пациенты с самыми последними стадиями онкологического заболевания получают возможность полностью избавиться от него на долгие годы. В то время, как пациенты с третьей стадией других болезней или даже того же вида рака, не отвечающего на иммунотерапию, неуклонно прогрессируют и умирают.
Пример: 2 пациента с идентичным распространением одного и того же вида рака толстой кишки, но у одного из них есть высокий уровень микросателлитной нестабильности — фактора ответа на иммунотерапию, а у другого нет.
Онкология, как и многие другие разделы медицины, сегодня обращена в сторону персонализации. И недалек тот день, когда стадирование будет осуществляться по иному принципу — не по степени анатомического распространения, а исходя из биологических особенностей конкретного заболевания.
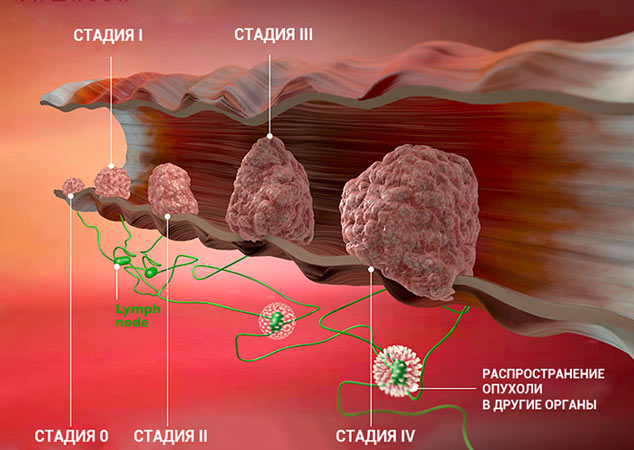
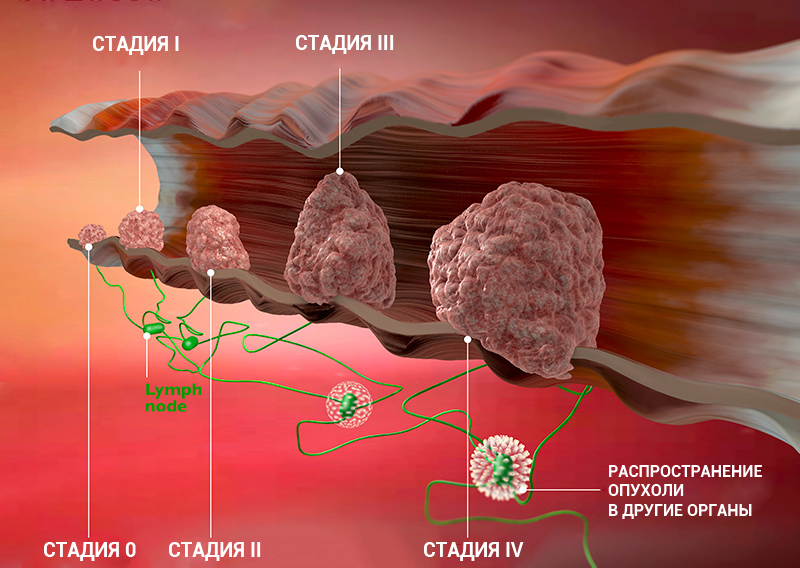
Стадии рака
Все опухоли (или, на языке врачей — новообразования) делят на две большие группы: доброкачественные и злокачественные. Первые обычно не опасны для жизни, а вторые, если человек не получает лечения, приводят к гибели. В 2015 году от рака во всем мире умерло почти 9 миллионов человек.
Фатальность злокачественных опухолей связана с двумя их главными свойствами, которые, собственно, и отличают их от доброкачественных новообразований:
Для врача важно понимать, насколько сильно рак успел распространиться в организме пациента. Ведь от этого зависит лечение и прогноз. Для того чтобы упростить эту задачу и внести четкость, в течении каждого онкологического заболевания принято выделять определенные стадии.
Классификация TNM
В большинстве случаев, для того чтобы установить стадию рака, ориентируются на три характеристики злокачественной опухоли, которые соответствуют трем буквам аббревиатуры TNM. К каждой букве приписывают индекс в виде цифры или специального обозначения.
T — tumor. Эта буква обозначает первичную опухоль, ее размеры, прорастание в стенку органа, соседние ткани:
N — nodus. Когда раковые клетки отрываются от первичной опухоли и мигрируют с током лимфы, в первую очередь они попадают в близлежащие (регионарные) лимфатические узлы. Можно сказать, что это первые баррикады на пути распространения рака в организме. В зависимости от того, обнаружены ли опухолевые клетки в регионарных лимфатических узлах, N может принимать значения:
M — metastasis. Эта буква показывает, обнаружены ли в теле больного отдаленные метастазы — вторичные очаги в различных органах:
Классификация TNM применима для большинства видов рака. Она позволяет очень подробно описывать злокачественные опухоли. В пределах основных групп выделяют подгруппы, их обозначают с помощью букв, например: T1a, T1b, T1c.
Однако, зачастую система TNM оказывается слишком громоздкой и не совсем удобной. Существует ее упрощенный вариант, когда возможные сочетания значений T, N и M сводят к пяти стадиям.
Стадии злокачественной опухоли
Часто онкологи обозначают стадию рака римской цифрой от I до IV. Эта классификация основана на TNM, но она проще и зачастую удобнее:
Это очень приблизительное описание стадий. Деление зависит от типа рака, от того, в каком органе он находится. Для того чтобы обозначить подстадию, к букве приписывают цифру. Например, стадия I может делиться на подстадии IA и IB.
Сторожевой лимфатический узел
Когда хирург оперирует онкологического пациента, зачастую ему приходится решать сложную задачу: стоит ли удалять регионарные лимфатические узлы? Если в них есть раковые клетки, и они будут оставлены в организме больного, произойдет рецидив. Если же удалить «чистые» лимфоузлы, это чревато осложнением в виде лимфедемы — отека на руке или ноге из-за нарушения оттока лимфы.
Раньше врачи нередко предпочитали меньшее из зол и удаляли лимфатические узлы «на всякий случай». Современные хирурги уже не действуют вслепую и могут более точно определить показания к лимфодиссекции. Это стало возможно благодаря появлению сентинель-биопсии или биопсии сторожевого лимфатического узла.
Сторожевым называется лимфатический узел (или группа лимфатических узлов), который первым принимает лимфу, оттекающую от злокачественной опухоли. Его можно обнаружить во время операции: для этого нужно ввести в опухоль флуоресцентный краситель или препарат с радиоактивной меткой. Препарат проникает в лимфатические сосуды, затем в сигнальный лимфоузел и «прокрашивает» его. Лимфатический узел удаляют и проверяют, нет ли в нем раковых клеток.
Для обозначения состояния сигнального лимфоузла используют специальную классификацию:
Если в сигнальном лимфоузле обнаружена опухолевая ткань — это показание к удалению регионарных лимфоузлов.
Степень злокачественности
Злокачественность и степень дифференцировки — два показателя, которые тесно взаимосвязаны. Они описывают внешний вид раковых клеток под микроскопом. Степень дифференцировки показывает, насколько раковая клетка отличается от здоровой. Если она высокая — опухолевая ткань похожа на здоровую. Низкодифференцированные раковые клетки полностью теряют сходство с нормальными.
Чем ниже степень дифференцировки и выше злокачественность, тем агрессивнее ведет себя рак и быстрее распространяется в организме. Для оценки используют гистологическую классификацию:
Шкала Глисона при раке простаты
Для того чтобы оценить степень злокачественности и агрессивности рака предстательной железы, используют шкалу Глисона, разработанную в 1960-х годах. В зависимости от того, как опухолевая ткань выглядит под микроскопом, ей присваивают оценку от 1 до 5. Чем ниже оценка, тем более высокодифференцированными и менее злокачественными являются клетки. Патологоанатом должен выявить два преобладающих типа ткани и выставить две оценки. Итоговая сумма баллов может колебаться от 2 до 10. Чем она больше, тем агрессивнее ведет себя опухоль, и выше риски.
Классификации рака печени
Классификация TNM не очень хорошо отражает течение злокачественных опухолей печени, поэтому в разных странах были созданы специальные классификации печеночно-клеточного рака. Например, многие врачи используют Барселонскую клиническую классификацию. В ее рамках выделяют следующие стадии рака печени:
В некоторых странах практикуется классификация итальянской программы по изучению рака печени (CLIP). В ней учитывается четыре фактора: состояние функции печени, распространение опухолевых очагов (больше или меньше половины печени), уровень альфа-фетопротеина (опухолевый маркер) и наличие тромбоза портальной вены. По каждому показателю врач выставляет оценку 0, 1 или 2 балла. Выживаемость пациентов зависит от суммы баллов:
В соответствии с системой CLIP, всех больных печеночно-клеточным раком можно поделить на две группы: 0–2 балла — значительно более благоприятный прогноз; более 2 баллов — значительно менее благоприятный прогноз.
В 1985 году была предложена классификация Okuda, в которой учитываются: степень поражения печени, наличие асцита (скопления жидкости в брюшной полости), изменение уровня альбумина и билирубина в крови. В соответствии с классификацией Okuda, выделяют три стадии рака печени:
Почему важно установить стадию злокачественной опухоли?
Знание стадии рака по TNM и другим системам помогает онкологу решать важные задачи:
Единые классификации помогают врачам из разных клиник и стран «разговаривать на одном языке». Видя стадию опухоли, диагностированную в другой клинике, онколог четко понимает, что это значит, и как дальше работать с пациентом.
| Серозная карцинома высокой степени злокачественности | |
|---|---|
 | |
| Иммуногистохимическая микрофотография рецепторов андрогенов на образце опухоли HGSC |
Содержание
Факторы риска
Факторы экологического риска
Теория «непрекращающейся овуляции » основана на сильной корреляции между количеством овуляторных циклов человека и риском рака яичников.
Эта тенденция отражается в защитных эффектах беременности, деторождения и грудного вскармливания от рака яичников, а также в аналогичных результатах эпидемиологических исследований, которые указывают на снижение риска, связанного с использованием оральных противозачаточных таблеток.
Напротив, была обнаружена временная связь с гормональной терапией в период менопаузы и заболеваемостью HGSC, а синдром поликистозных яичников (СПКЯ), как было показано, способствует удвоению риска рака яичников.
Эндометриоз может повышать риск других подтипов рака яичников, но не связан с HGSC.
Генетические факторы риска
Недавняя модель на мышах предполагает, что мутация p53 может индуцировать HGSC, возникающие из яичника, а не из фаллопиевой трубы.
Патофизиология
Происхождение клетки
Кроме того, HGSC отличаются от LGSC по номенклатуре опухолей яичников «тип I / II»; тип I относится к типам опухолей (например, LGSC), где были охарактеризованы предшествующие поражения в яичнике, а тип II относится к типам опухолей (например, HGSC) без ассоциации таких поражений, опухоли, которые, как считается, развиваются de novo из маточных труб и / или яичников поверхностный эпителий. Эта классификация имеет большее отношение к исследованиям, чем к клинической практике.
Обычное мюллеровское происхождение маточных труб, матки, шейки матки и верхних отделов влагалища привело к предположению, что серозная карцинома брюшины высокой степени злокачественности представляет собой спектр одного заболевания.
Соответствующие животные модели HGSC могут быть разработаны только при правильном понимании клеточного происхождения. Однако, поскольку HGSC имеет тенденцию к одинаковому клиническому поведению, независимо от его первичного клеточного происхождения, определение клеточного происхождения менее важно для клинического лечения, но может иметь значение при поиске биомаркеров.
Конкретный процесс, посредством которого возникает HGSC, может быть связан со статусом мутации BRCA индивидуума, а также статусом мутации p53.
В статье 2007 года описан процесс определения происхождения клетки следующим образом: «Происхождение опухоли обычно приписывается органу с преобладающей опухолевой массой. Единственным исключением является брюшина, которая классифицируется как первичный участок только в том случае, если предполагаемое происхождение не обнаружено в эндометрии, трубке или яичнике ».
Признано, что HGSC может иметь различное и сложное первичное происхождение, но понимание и определение этого даст представление о его патогенезе.
Патогенез
Предполагая фимбриальное происхождение, как это наблюдается в большинстве случаев HGSC, текущее понимание генеза HGSC предполагает процесс, посредством которого фимбриальные клетки STIC имплантируются в яичник в виде цист кортикального включения через место разрыва овуляции.
Чтобы учесть случаи, когда нет вовлечения STIC, также возможны эндосальпингиоз или метаплазия de novo включений поверхностного эпителия яичников. Гораздо более редким явлением является дифференциация HGSC от LGSC.
Диагностика
Трансвагинальное ультразвуковое исследование, а также анализ уровня онкологического маркера CA125 часто используются для определения потенциальной злокачественности подозрительных образований таза.
Если видно, что железы сливаются с замысловатыми, обширными сосочками с эпителиальными пучками и твердыми гнездами, окруженными пространством рядом с нерегулярными щелевидными пространствами, то подозревается серозная карцинома.
Различия между LGSC и HGSC:
Отличить HGSC от эндометриоидной карциномы высокой степени не всегда возможно.
Скрининг
Поскольку рак яичников редко проявляется симптомами до поздней стадии, регулярный превентивный скрининг является особенно важным инструментом для предотвращения поздней стадии, на которой обращаются большинство пациентов. Однако исследование, проведенное в США в 2011 году, показало, что трансвагинальное ультразвуковое исследование и скрининг на онкологический маркер CA125 не снижают смертность от рака яичников. Напротив, более недавнее исследование в Великобритании показало, что до 20% случаев смерти от рака яичников можно предотвратить за счет ежегодного выполнения этих процедур.
Профилактика
Профилактическая сальпингоофорэктомия часто выполняется носителям мутаций BRCA1 или BRCA2, хотя преимущества, предоставляемые этой процедурой, могут варьироваться в зависимости от конкретной мутации.
лечение
От 20% до 30% пациентов рецидивируют в течение шести месяцев лечения.
Эпидемиология
Исследование показателей заболеваемости в США в период с 1992 по 1999 год показало, что повозрастная заболеваемость HGSC удваивается каждые 10 лет до возраста 55 лет, где она составляет примерно 20 случаев на 100000 женщин, а после 75 лет резко падает.
Уровень заболеваемости раком яичников низкий в Восточной Азии и самый высокий в Европе, США и Австралии / Новой Зеландии.
С 1975 года показатели выживаемости при раке яичников неуклонно улучшались: к 2006 году в среднем на 51% снизился риск смерти от рака яичников при опухоли поздней стадии. Увеличение произошло в основном за счет успешного увеличения продолжительности жизни пораженных пациентов, а не за счет улучшения показателей излечения.
Между черными и белыми женщинами существует расовое неравенство в США, где чернокожие женщины подвергаются более высокому риску смертности от рака яичников.
Лечение немышечно-инвазивного рака мочевого пузыря высокого риска
С.А. Иванов, И.Н. Заборский, В.С.
Чайков Медицинский радиологический научный центр им. А.Ф. Цыба ‒ филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» МЗ РФ; Обнинск, Россия
Автор для связи: Заборский Иван Николаевич Тел.: +7 (484) 399-32-56; e-mail: i.zaborskii@mail.ru
Введение
Рак мочевого пузыря (РМП) – одна из самых распространенных опухолей мочевыводящего тракта. В Российской Федерации на 2015 год частота встречаемости РМП на 100 000 тысяч населения составила 68,3. Прирост частоты встречаемости от 2005 года составил 22,3 [1].
Определение группы высокого риска
К немышечно-инвазивным формам рака мочевого пузыря (НМИ РМП) относятся следующие формы: Тis, Ta, T1. Распространенность опухоли от T2 до T4 относится к мышечно-инвазивным формам.
Для уротелиального рака согласно действующей системе ВОЗ /Международного общества уропатоморфологов (WHO/ISUP) рекомендуется следующее разделение по степеням дифференцировки:
Европейская организация по исследованию и лечению рака (EORTC) разработала систему распределения больных на 3 группы риска рецидива и прогрессии: низкого, высокого и промежуточного. В ее основе лежит мета-анализ результатов лечения 2596 больных РМП Та-Т1, включенных в 7 рандомизированных исследований EORTC. Каждому из перечисленных выше факторов риска присвоен балл соответственно степени его влияния на развитие рецидива или прогрессии. Суммой баллов определяется группа риска. Согласно рекомендациям Европейской урологической ассоциации, на 2017 год выделяют 3 группы риска, в которых значимо различаются частоты рецидивов и прогрессии в мышечно-инвазивный рак.
К группе низкого риска относятся: одиночная опухоль, 3см) T1G3/ HG и/или рецидивирующие опухоли T1G3/HG – T1G3/HG с карциномой in-situ простатического отдела уретры – атипичные формы уротелиальной карциномы – лимфососудистая инвазия
Неэффективность внутрипузырной БЦЖ-вакцины
Рекомендуется проведение радикальной цистэктомии.
Проведенный мета-анализ 7 рандомизированных исследований (1476 пациентов), изучивших однократное введение химиопрепаратов, в первые 24 часа после проведенной ТУР снижает риск рецидивирования у пациентов, получавших внутрипузырную химиотерапию на 11%. Эффект от ранней адъювантной химиотерапии отмечался как для одиночных, так и для множественных опухолей. Наиболее распространенным препаратом для внутрипузырной химиотерапии является Митомицин С, но значимых различий от применения различных препаратов (эпирубицина, доксорубицина и Митомицина С) получено не было [13].
По данным EAU, применение повторной внутрипузырной химиотерапии терапии для лечения рецидивных опухолей High Grade после проведенного оперативного лечения и ранее проведенной внутрипузырной химиотерапии не целесообразно. В данном случае препаратом выбора является вакцина БЦЖ.
Внутрипузырная иммунотерапия вакциной БЦЖ (Бацилла Calmette-Guerin) показала свою эффективность в профилактике рецидива РМП после выполненной ТУР. Мета-анализ 13 рандомизированных исследований, включающий в себя 2548 пациентов показал, что внутрипузырная имуннотерапия увеличивает время безрецидивной выживаемости на 38% (HR, 0.62. 95% Cl 0.50.77, р
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора: