что такое nmda рецепторы
NMDA рецептор в нейропсихиатрии
Некоторые нейротрансмиттеры связаны с развитием психотических симптомов, причем дофамин и серотонин являются наиболее изученными из-за лечебного эффекта блокирования определенных подтипов этих рецепторов антипсихотиками. К сожалению, длительное лечение типичными или атипичными антипсихотиками ограничено из-за профиля побочных эффектов и высокой частоты прекращения лечения со стороны пациента. NMDA рецепторы также участвуют в развитии психотических симптомов и являются потенциальной мишенью для разработки новых методов лечения в будущем.
Известно, что NMDA-рецептор играет важную роль в регуляции передачи сигнала во многих областях мозга. Соответственно, любая гомеостатическая дисфункция активности рецептора NMDA может привести к различным патологиям. Отметим, что исследователи обнаружили особенно высокую концентрацию постсинаптических NMDA-рецепторов в лимбических структурах.
Антагонисты N- метил- d- аспартатного рецептора представляют категорию соединений, которые функционально ингибируют или дезактивируют активность рецептора NMDA. Они могут действовать широко или специфически на различные сайты рецептора NMDA, включая агонист-связывающие домены, аллостерические сайты и поры ионных каналов. Эта категория соединений ( препаратов) иожет применяться при любом заболевании, которое возникает в результате вызванной глутаматом эксайтотоксичности, от церебральной ишемии и эпилепсии до нейродегенеративных расстройств и невропатической боли. Более поздние разработки сосредоточены на уже субъединичных специфических соединениях, включая NR2B-селективные антагонисты, которые привели к минимизации побочных эффектов с повышенной терапевтической эффективностью. Агонисты NMDA-рецепторов, с другой стороны, относятся к категории соединений, нацеленных на NMDA-рецепторы, которые могут усиливать рецепторную активность. Интересно отметить, что некоторые психические расстройства можно лечить как антагонистами, так и агонистами NMDA-рецепторов. Эти двухфазные нарушения в отношении активности рецептора NMDA могут требовать индивидуальных протоколов лечения в зависимости от стадии заболевания.
Шизофрения
Первоначальные данные в поддержку более новой гипотезы о гипофункции глутамата при шизофрении были получены из сообщений о низких уровнях глутамата в спинномозговой жидкости у пациентов с шизофренией. Дальнейшие исследования подтверждают эту теорию и показывают, что введение антагонистов NMDA-рецепторов, включая фенциклидин (PCP) и кетамин, пациентам с шизофренией приводило к усилению психотических симптомов. Дополнительные исследования показывают, что введение подобных антагонистов здоровым пациентам продуцирует симптомы шизофрении, включая позитивные, негативные и когнитивные симптомы. Основываясь на этих данных, более современные фармакологические подходы, направленные на лечение шизофрении, фокусируются на использовании агонистов NMDA-рецепторов. Однако, прямая активация рецептора и сообщаемая эксайтотоксичность предполагают необходимость более конкретно исследовать сайт связывания глицина как потенциально более безопасную косвенную мишень для лечения нарушений гипофункции глутамата. Ряд исследований в настоящее время изучают этот механизм как средство лечения симптомов с минимальными побочными эффектами.
Аффективные расстройства
Болезнь Хантингтона
Глутаматные рецепторы
Глутамат натрия владеет умами
Как много сплелось в этом слове для нашего человека! Одни боятся «страшного и ядовитого глутамата натрия» как огня, другие же являются ценителями вкуса “умами”. Автор даже слышал истории о том, как некоторые счастливчики смогли выкрасть с работы в колбасном цеху целый килограмм глутамата!
Глутамат (он же глутаминовая кислота) впервые был открыт немецким химиком Карлом Генрихом Раттгаузеном в 1866 году. Он изучал продукты взаимодействия глютена (смеси белков, получаемых из злаковых растений) с серной кислотой. В 1907 году японец Икэда Кикунаэ, изучая состав водорослей комбу и их применение в пищевой промышленности, решил попробовать на вкус кристаллы, оставшиеся после выпаривания бульона из водорослей. К его удивлению, вкус оказался таким же, как и у цельных кусков комбу, используемых в кулинарии. Позднее, идентифицировав состав осадка, Икэда понял, что выделил глутамат. Позднее он улучшил и запатентовал свой метод получения глутамата из водорослей (именно тогда при очистке сырья глутамат начали переводить в форму натриевой соли). Этот метод интересен также и тем, что был применён в первом производстве бульонных кубиков в Японии. Японцы, кстати говоря, очень высоко оценили такой вкус и даже придумали для него слово “умами”, дословно – приятный вкус.
Впервые глутамат был обнаружен в организме животных в 1940-х годах. В 50-х было установлено, что наибольшие его концентрации отмечаются в органах, составляющих нервную систему. В конце 50-х годов группа учёных под руководством Дэвида Кёртиса и Джефри Уоткинса установила, что глутамат может выполнять роль нейротрансмиттера в нервной системе. В своих опытах на изолированном спинном мозге жабы учёные впервые наблюдали эффекты глутамата in vivo: в концентрациях 10-2 – 10-4 М вещество сначала возбуждало нейроны, а затем, подобно открытой и описанной ранее ГАМК, проявляло тормозящие свойства. В дальнейшем те же учёные провели опыт на изолированных клетках Реншоу – вставочных нейронах спинного мозга, регулирующих мышечный тонус путём выброса глицина, тормозного нейромедиатора. Эти клетки к тому времени были достаточно хорошо изучены: о них уже было известно то, что они являются тормозными нейронами и что их активность избирательно стимулируется ацетилхолином. В процессе опытов in vitro выяснилось, что они, как оказалось, могут также быть активированы и глутаматом в достаточных концентрациях! Интересно, что была проведена серия опытов не только с L-глутаматом, который и присутствует в нервной системе в нормальных условиях, но и с его D-изомером. Также были опыты с L- и D-изомерами аспартата, который структурно схож с глутаматом. Таким образом, изначально глутамат и близкие к нему по структуре соединения получили название «возбуждающие аминокислоты» (excitatory amino acids). В 70-х годах было выдвинуто предположение о разделении рецепторов возбуждающих аминокислот на NMDA и не-NMDA. Данное предположение было основано на опытах с единичными нейронами из разных отделов нервной системы: N-метил-D-аспартат в тех же концентрациях, что и глутамат, возбуждал нейроны спинного мозга сильнее, нежели чем нейроны мозга головного. Также выяснилась интересная вещь: избирательные блокаторы NMDA-рецепторов блокировали только их, в то же время неизбирательные блокаторы рецепторов возбуждающих аминокислот подавляли активность нейронов как в спинном, так и в головном мозге. При скрининге активности производных различных аминокислот среди NMDA-рецепторов были выделены ещё два класса – каинатные рецепторы (возбуждаются каиновой кислотой) и АМРА-рецепторы (возбуждаются альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислотой). В начале 80-х годов выявлена роль глутаматных рецепторов в феномене долговременной потенциации (LTP), когда при повторяющемся выбросе нейромедиаторов с пресинаптического нейрона на постсинаптический он начинает возбуждаться при меньших концентрациях нейромедиатора. Этот эффект лежит в основе явления синаптической пластичности и может быть описан правилом Хэбба: «Если аксон клетки А расположен достаточно близко к клетке Б, чтобы возбуждать её, и постоянно участвует в её активации, то в одной или обеих клетках происходят такие метаболические изменения или процессы роста, что эффективность А как одной из клеток, активирующих Б, повышается». Таким образом, глутаматергические нейроны являются одним из главных звеньев процессов обучения и запоминания. В 90-х, благодаря применению молекулярно-биологических методов изучения работы рецепторов глутамата, они были разделены на ионотропные (iGlu) и метаботропные (mGlu). К ионотропным (т.е. представляющим собой ионный канал) рецепторам отнесли NMDA, AMPA и каинатные. К метаботропным – все остальные, которые разделили на 3 группы в зависимости от наблюдаемых при возбуждении эффектов.
NMDA-рецепторы
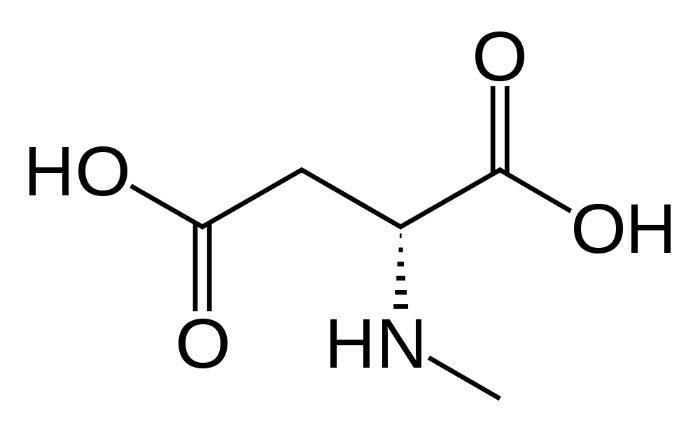
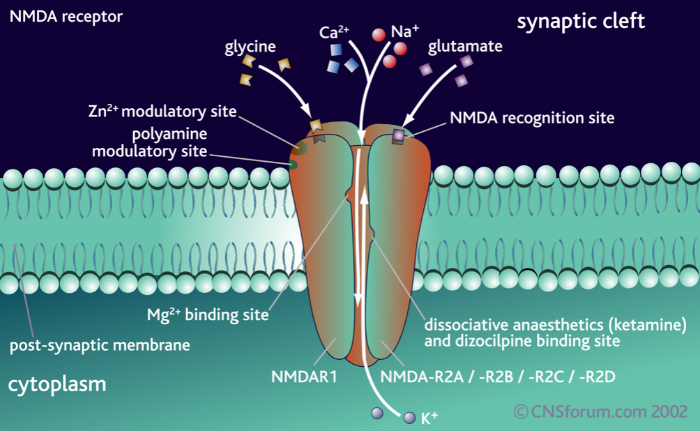
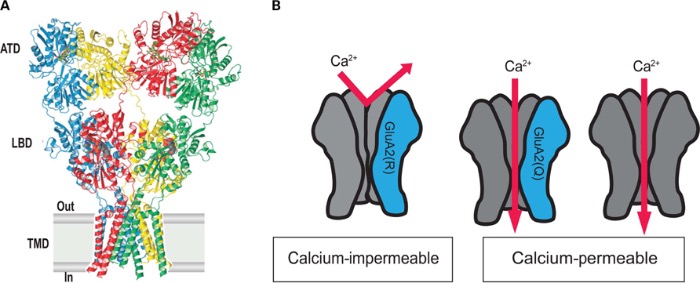
Данный тип рецепторов глутамата представляет собой одновременно потенциал-зависимый и лиганд-зависимый ионный канал, избирательно пропускающий положительно заряженные ионы. Исключение составляют ионы магния и цинка, которые, находясь вне клетки, выступают в качестве блокаторов. Таким образом, основную часть ионного тока составляют ионы кальция и натрия – их данный ионный канал пропускает внутрь клетки, и ионы калия – их он из клетки выпускает. Стоит отметить интересную особенность NMDA-рецептора: он не может быть активирован лишь одной молекулой лиганда. Для открытия ионного канала необходимо два лиганда на разных субъединицах. Лигандами могут быть только D-изомеры аминокислот-нейромедиаторов.
Структурно NMDA-рецептор состоит из четырёх субъединиц, две из которых являются представителями класса NR1, и две другие – представителями класса NR2. В середине нулевых также был выделен новый класс субъединиц – NR3, о нём мы поговорим отдельно.
На внеклеточной части рецептора расположены сайты связывания различных модуляторов и агонистов. Здесь у субъединиц NR2 расположен сайт связывания глутамата, аспартата и собственно N-метил-D-аспартата, а у субъединиц NR1 – сайт связывания ко-агониста – глицина или серина.
Трансмембранная часть формирует ионный канал, и также стоит отметить, что именно эта часть рецепторного белка богата сайтами связывания различных агонистов – от всем известных анестетика кетамина и диссоциатива PCP (фенциклидин) до модельных NMDA-блокаторов, таких как MK810, который часто используют в фармакологических исследованиях. Наконец, внутриклеточная часть NMDA-рецептора: она является регуляторной и может взаимодействовать с различными киназами и фосфатазами, которые путём фосфорилирования или дефосфорилирования влияют на активность ионного канала.
С этим типом субъединиц связан интересный феномен. В мозге новорождённых и молодых млекопитающих в составе NMDA-рецепторов преобладает NR2B-субъединица. При активации рецепторов, которые содержат эту субъединицу, соответствующие каналы остаются в открытом положении гораздо дольше. Кроме того, нейроны с такими рецепторами быстрее развивали долговременную потенциацию. Однако с возрастом большая часть NR2B-субъединиц в рецепторных комплексах заменяется на NR2C и NR2A. Это отчасти объясняет снижение с возрастом способностей к обучению, так как долговременная потенциация является одним из ключевых механизмов в процессе запоминания. Не стоит думать, что такая «замена» направлена исключительно во вред организму – в опытах in vivo и in vitro установлено, что клетки с NR2B-субъединицами не имеют никакой защиты от эксайтотоксичности, в то время как преобладание рецепторной субъединицы NR2A значительно повышало порог, при котором наступала клеточная гибель.
GluN3, он же NR3 – это относительно недавно открытая группа белков, существующих в вариантах NR3A и NR3B и являющихся субъединицами NMDA-рецептора. У генов белков субъединиц третьей группы наблюдается наименьшая гомология с остальными генами субъединиц не только NMDA-рецептора, но и других глутаматных ионотропных рецепторов. Интересно также, что гомология между генами белков этой группы меньше, чем гомология внутри остальных групп. Однако, как и во второй группе, соотношение различных вариантов субъединиц также изменяется с возрастом.
Относительное изменение количества различных вариантов NR3-субъединицы с возрастом.
Как видно из вышеприведенных абзацев, NMDA-рецепторы со временем изменяют свой состав и комбинации субъединиц. Это нормальное явление, наблюдаемое не только у человека, но и у других позвоночных. К сожалению, конкретный механизм такой замены ещё не до конца ясен, а самое главное – пока что не выявлены эпигенетические механизмы, лежащие в основе таких изменений.
Лиганды NMDA-рецепторов
Помимо этих известных препаратов, в клиническом использовании до сих пор находятся флупиртин (анальгетик) и мемантин (используется для лечения деменций различного генеза). Интересно также, что в опытах на животных NMDA-антагонисты эффективно предотвращали гибель нейронов от эксайтотоксичности, однако при длительном и частом введении в больших количествах они вызывали специфическое поражение ЦНС, названное лезиями Олни (в честь учёного, впервые их описавшего – Джона Олни). В отдельных публикациях были описаны т.н. пограничные морфологические состояния. Например, у крыс после длительной анестезии оксидом азота (I) наблюдалась вакуолизация цитоплазмы нейронов – обычно после данного процесса происходит гибель нейронов путем некроза или апоптоза.
Агонисты NMDA-рецепторов в клинике практически не используются. В 2015 году был зарегистрирован препарат небогламин. В опытах на животных он показал способность ускорять обучение и процессы запоминания. Также в процессе испытаний была выявлена способность небогламина избавлять от кокаиновой зависимости.
Рецепторы, содержащие в своём составе GluR1-субъединицу, обнаруживаются чаще всего в гранулярных и пирамидальных клетках гиппокампа.
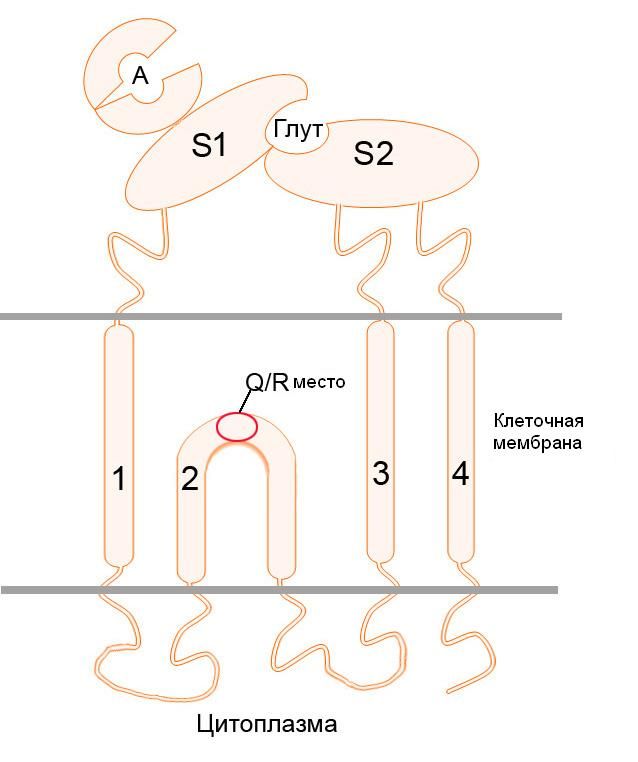
Субъединица GluR2 является необходимой для группы АМРА-рецепторов, которые не пропускают ионы кальция. Интересно, что перед началом трансляции мРНК гена данной субъединицы взаимодействует с белком ADAR (аденозилдезаминаза РНК), который заменяет триплет CAG на CIG (аденозин заменяется на инозин). Соответствующие изменения наступают и в структуре белка – глутамин в 607-й позиции заменяется на аргинин, также, в 764 позиции аргинин заменяется на глицин. В опытах на трансгенных мышах, у которых данный процесс редактирования мРНК был нарушен и АМРА-рецепторы с GluR2-субъединицей были проницаемы для ионов кальция, у животных наблюдались симптомы, схожие с амиотрофическим боковым склерозом. Данная замена аминокислот затрагивает структуру самого ионного канала, а точнее – сайта, ответственного за пропуск ионов с зарядом 2+. Таким образом, нейроны с дефектной GluR2-субъединицей, пропускавшей ионы кальция, были подвержены «физиологической» эксайтотоксичности вследствие повышенной концентрации глутамата в синапсе, которая в нормальных условиях не возникала благодаря избирательной блокаде входа кальция в клетку через конкретно этот тип каналов. Интересно, что при полном выключении редактирования мРНК GluR2, когда не происходило замен глутамин-аргинин и аргинин-глицин, трансгенные мыши умирали в младенчестве от судорог. Такая же замена была обнаружена и при изучении синтеза субъединиц каинатных рецепторов GluR5 и GluR6, однако у них данная замена, наоборот, увеличивает пропускную способность ионного канала в отношении Ca2+. Антитела к GluR2 также используются при иммуногистохимическом выявлении солитарной фиброзной опухоли (SFT) и выбухающей дерматофибросаркомы (DFSP).
Структура AMPA-рецептора, Q/R – название места замены глутамина на аргинин.
Рецепторы с GluR2, прошедшим на уровне мРНК правильную обработку, непроницаемы для ионов кальция.
GluR3-субъединица.
Эта субъединица, как и GluR2, проходит редактирование на уровне мРНК. Замена в данном случае также происходит благодаря ферментам группы ADAR. В данном случае – ADAR3, который находится исключительно в тканях нервной системы. Однако здесь замена носит необязательный характер – лишь в 80% случаев мРНК субъединиц GluR2 проходят соответствующее редактирование. Разница между отредактированными и неотредактированными субъединицами никак не отражается на выживаемости клетки: у рецепторов с отредактированными субъединицами состояние десенсибилизации длится короче.
GluR4-субъединица.
Специфических отличий от GluR2 и GluR3 субъединиц нет. У GluR4 обнаружена высокая гомология с генами этих субъединиц. Так же, как и GluR3, может встречаться в редактированном и неотредактированном варианте, в обоих случаях влияния на выживаемость нейрона не обнаружено. Согласно исследованиям японских генетиков, у гена субъединицы GluR4 существует 6 SNP-мутаций, которые повышают риск развития шизофрении.
АМРА, наряду с NMDA-рецепторами, является одним из главных звеньев в механизме долговременной потенциации, а значит, и в механизме запоминания. Долговременная потенциация (LTP) выражается в увеличении возбуждающего постсинаптического потенциала в ответ на какой-либо повторяющийся стимул. Согласно современным теориям, LTP в первую очередь связывают с апрегуляцией (увеличением плотности) АМРА-рецепторов на мембране постсинаптического нейрона.
Упрощённо механизм апрегуляции выглядит примерно так: на постсинаптическом нейроне находятся NMDA и АМРА-рецепторы и глутамат возбуждает АМРА-рецептор (NMDA в это время остаётся закрытым благодаря иону магния в ионном канале), и в клетку устремляются ионы натрия, что вызывает деполяризацию. Деполяризация мембраны как бы выталкивает магний из ионного канала в NMDA-рецепторе, таким образом открывая его для кальция. Кальций, входя в клетку, запускает каскад реакций, ведущий к увеличению плотности АМРА-рецепторов на мембране. Кроме того, кальций запускает работу киназы CaMKII, которая путём фосфорилирования регуляторных участков уже существующих АМРА-рецепторов увеличивает их проводимость.
Установлено, что АМРА-рецепторы, наряду с каинатными, являются также и ключевым звеном, задействованным в патогенезе судорожного синдрома. В настоящее время ведутся разработки новых противоэпилептических препаратов, избирательно блокирующих активность АМРА-рецепторов.
Как и NMDA, и АМРА-рецепторы, каинатный рецептор также является ионотропным. Своё название он получил благодаря каиновой кислоте, которая является первым открытым избирательным агонистом рецепторов данной подгруппы.
Каинатный рецептор состоит четырёх субъединиц, так же как и NMDA и АМРА. Однако не всё так просто – этих субъединиц на самом деле пять, но они могут быть совмещены в тетрамерных комплексах различного состава и по определённым правилам. Каинатный рецептор формирует ионный канал, проницаемый для натрия и кальция.
Стоит отметить, что после 2009 года произошло переименование субъединиц:
Теперь о правилах компоновки – Glu1-3 могут формировать гомотетрамеры, т.е. рецепторы, состоящие, например, только из GluK2 субъединиц. Однако GluK4 и GluK5 такой способности лишены и могут присутствовать лишь в составе гетеротетрамеров (одна GluK4 и три GluK3, например).
GluK1
GluK2
GluK3
Эта субъединица изучена чуть меньше, однако уже известны мутации (замена серина в 310 позиции на аланин), которые повышают риск развития белой горячки после запоев и шизофрении. Также описан случай, когда при генетическом обследовании пациента с отставанием в развитии обнаружилась микроделеция 1p34.3 (регион 34.3, малого плеча 1-й хромосомы), включающий в себя и ген этой субъединицы. Так как в указанном регионе находился только один ген, чьё участие в процессах, происходящих в нервной системе, не подвергается сомнению, то причину отставания в развитии связали именно с его отсутствием.
GluK4
Эта субъединица изучена больше в силу исторических причин – она долгое время считалась первой истинно-каинатной. Таким образом, функции этой субъединицы наиболее изучены клиницистами. Например, выявлены мутации гена этой субъединицы, которые влияют на восприимчивость пациента к циталопраму. Как уже упоминалось выше, каинатные рецепторы являются ключевым звеном патогенеза судорог, но в целом на выживаемость нейрона при эксайтотоксичности не влияют. Так вот эта субъединица является исключением – при избыточной активации рецепторов, её содержащих, эксайтотоксичность наступает. Это было подтверждено опытами на мышах (забавный факт – избирательных блокаторов GluK4 на момент проведения опыта в 2009 году не существовало, исследователи пользовались моноклональными антителами к данной субъединице) – при выключении этой субъединицы нейроны дольше выживали в условиях индуцированной эксайтотоксичности.
GluK5
Я, признаться, был несколько удивлён – несмотря на то, что данная субъединица была открыта еще в 1995 году, по ней крайне мало информации. О клиническом значении этой субъединицы существует лишь одна публикация, и то – с отрицательными результатами исследований корреляции различных SNP в её гене с риском психических и неврологических заболеваний. Однако, существует публикация 2013 года, за авторством учёных из Университета Бордо. Они показали, что фосфорилирование GluK5 с помощью уже упомянутой ранее киназы CaMKII регулирует плотность рецепторов на постсинаптической мембране.
Касательно каинатных рецепторов, для того, чтобы ещё раз подчеркнуть их важность и функции, следует упомянуть такой нейротоксин, как домоевая кислота. Это соединение является сильным агонистом ионотропных глутаматных рецепторов, в основном связывается с каинатными рецепторами гиппокампа, вызывая избыточную активацию этих самых рецепторов и, таким образом, оказывая эксайтотоксическое действие. Помимо общей неврологической симптоматики, частым симптомом отравления является временная антероградная амнезия – неспособность запоминать новую информацию. Механизм действия этого токсина прекрасно подтверждает как роль гиппокампа в процессах запоминания, так и роль глутаматных рецепторов в процессе установления долговременной потенциации.
Про ионотропные глутаматные рецепторы, в целом следует также рассказать о «молчащих синапсах». Это «несозревшие» синапсы, которые содержат NMDA-рецепторы, однако практически лишены АМРА-рецепторов. В таких случаях, даже если глутамат и ко-активатор связываются с NMDA-рецептором, он остаётся закрытым, ионный канал для кальция заблокирован ионом магния – который может отсоединиться лишь в случае смены потенциала благодаря работе АМРА-рецепторов, которых в данном случае нет. Именно поэтому такой синапс и называется «молчащим». Такие синапсы постепенно могут перейти в нормальное активное состояние – достаточно вызвать сильную деполяризацию мембраны, чтобы освободить ионный канал в NMDA-рецепторе для кальция, который затем активирует CaMKII и кальмодулин. А они уже через цепь посредников запустят процесс экзоцитоза везикул с AMPA-рецепторами, в результате которого эти рецепторы будут выставлены на постсинаптической мембране, делая синапс полноценным.
И ещё – среди ионотропных рецепторов глутамата выделено два рецептора-сироты – GluD1 и GluD2. Эндогенные лиганды этих рецепторов ещё не найдены, глутаматом они не активируются, а в эту группу отнесены были лишь по доброте душевной и высокой гомологии. С помощью синтетических лигандов даже выяснена их роль – они отвечают за развитие синаптических связей в мозжечке, главным образом находясь в клетках Пуркинье. В опытах на животных мыши с определённым мутантным вариантом этого рецептора умирали вскоре после рождения – при исследовании мозга было обнаружено значительное уменьшение объёма заднего мозга. Люди добрые, не проходите мимо! Помогите этим рецепторам найти свои эндогенные лиганды!
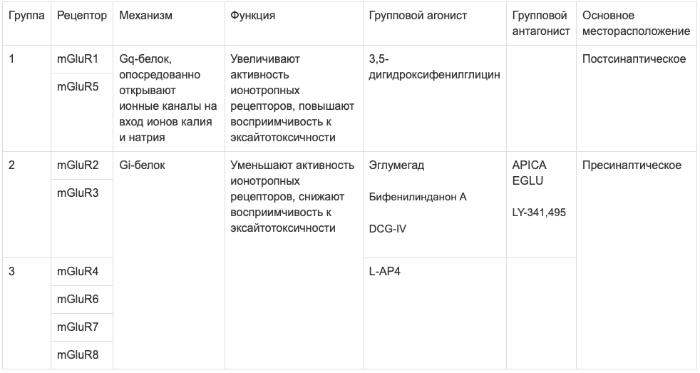
Метаботропные рецепторы разделены на три группы в зависимости от их механизма работы, гомологии структуры и перечня селективных лигандов. Всего существует три группы:
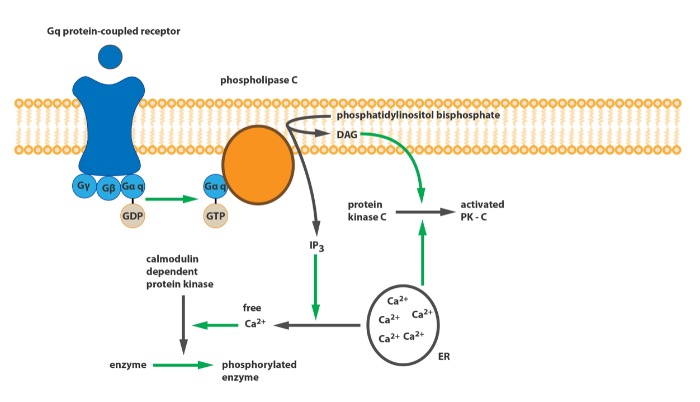
Во-первых, группы рецепторов различаются по механизму действия. Рецепторы первой группы связаны с Gq-белком. При активации тот запускает фермент фосфолипазу С (PLC), который осуществляет расщепление фосфатидилинозитол-4,5-фосфата (PIP2) на диацилглицерол (DAG) и инозитол-1,4,5-трифосфат (IP3). DAG в свою очередь активирует протеинкиназу С (PKC), которая осуществляет фосфорилирование других белков; а IP3 служит агонистом IP3-рецепторов, которые запускают высвобождение кальция из эндоплазматического ретикулума, таким образом, ионы кальция активируют кальмодулин-зависимые протеинкиназы, также участвующие в фосфорилировании белков.
Принципиальная схема работы Gq-связанного рецептора
Остальные группы глутаматных рецепторов, вторая и третья, осуществляют своё действие через Gi-белок. Это означает, что при активации этих рецепторов блокируется работа аденилатциклазы, которая в активном состоянии превращает АТФ в цАМФ. Следовательно, останавливается работа цАМФ-зависимой протеинкиназы (второе название – протеинкиназа А, PKA), и каскад реакций фосфорилирования, изменяющих гомеостаз кальция, не запускается. Исходя из вышеизложенного, можно уяснить различия в эффектах этих рецепторов: при активации рецепторов 1 группы активность NMDA и АМРА-рецепторов увеличивается (в т.ч. за счёт повышения синаптической плотности), но также увеличивается восприимчивость к эксайтотоксичности; при активации рецепторов 2 и 3 групп, наоборот, активность и плотность ионотропных рецепторов уменьшается, также уменьшается вероятность возникновения эксайтотоксического возбуждения.
Можно заключить всё в небольшую таблицу.
Касательно групповых агонистов стоит сделать ещё небольшую заметку. Агонисты рецепторов 2 группы в основном проявили себя как антипсихотики – например, бифенилинданон А (BINA) даже смог купировать модельный психоз, вызванный ДОБом, DCG-IV показал себя как антиконвульсант. Однако, оба эти вещества нарушали процессы запоминания. Причём, в отличие от домоевой кислоты, чьё амнестическое действие возникает из-за прямой индукции эксайтотоксичности в нейронах гиппокампа, агонисты метаботропных рецепторов 2 группы лишь блокировали «молекулярный субстрат», необходимый для возникновения долговременной потенциации. Таким образом, можно разделить метаботропные рецепторы на возбуждающие и тормозные, хотя такое разделение лишь условно.
Говорить об отдельных рецепторах можно и вне контекста группы, однако отдельные особенности рассмотреть однозначно стоит.
1 группа
mGluR1
Находится на адренергических нейронах и является положительным модулятором активности соответствующих рецепторов – селективные антагонисты mGluR1 оказывают адренолитическое действие. В исследованиях на мышах, лишённых гена данного рецептора, выявлено отсутствие каких-либо макро- и микроскопических патологий. Однако в тестах на координацию движений и запоминание мыши без этого рецептора показали худшие результаты по сравнению с контрольной группой. Интересно, что имеются сообщения о случаях, когда при болезни Ходжкина организм пациента вырабатывал аутоантитела к mGluR1, что выражалось в виде паранеопластической атаксии. Мутации гена этого рецептора также могут быть причиной рецессивной спиноцеребеллярной атаксии.
mGluR5
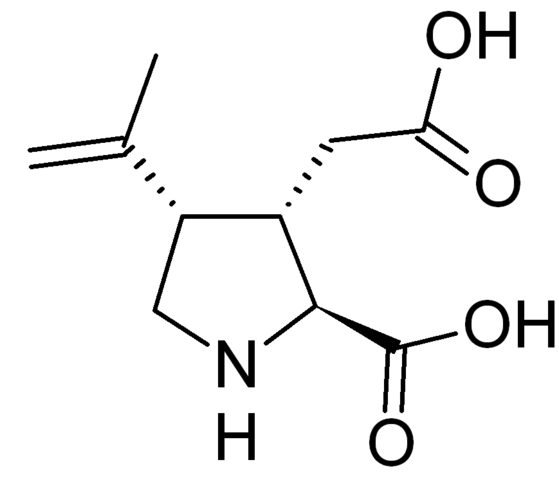
Этот метаботропный рецептор интересен тем, что является одной из мишеней лития в организме. Литий (в форме кислых органических солей или карбоната) применяется в медицине в качестве нормотимика. На рецепторе имеется три сайта связывания – один для глутамата, а два других – для модуляторов и экзогенных лигандов, что делает mGluR5 перспективной мишенью для разработки нормотимиков, антидепрессантов и транквилизаторов. Например, лиганды этого рецептора, лишённые способности проникать через ГЭБ, исследуются в качестве средств, влияющих на тонус мочевого пузыря. Однако клиническое использование антагонистов и негативных модуляторов mGluR5 скорее всего будет ограниченным, так как уже в исследованиях на крысах данный класс соединений наряду со способностью снимать тревогу показал негативный побочный эффект – нарушения памяти. Агонисты mGluR5 исследуются в качестве средств против деменции и для восстановления после травм, уже опубликованы положительные результаты с 2-хлоро-5-гидроксифенилглицином в качестве перспективного агониста.
2 группа
mGluR2
mGluR3
Мутации гена этого рецептора повышают риск развития биполярного расстройства, шизофрении и склонности к зависимостям. Соответственно, как и mGluR2, данный рецептор также является мишенью для различных экспериментальных препаратов. Более того, благодаря высокой гомологии (в т.ч. и сайта связывания) в научной литературе некоторые групповые лиганды обозначаются как mGluR2/3-агонисты (или антагонисты). Также мутации в гене этого рецептора могут влиять на риск развития меланомы – в 16,3% случаев меланомы, у пациента обнаруживается мутация mGluR3, выражающаяся в замене глутамина в 870 позиции на лизин.
3 группа
mGluR4
Этот рецептор интересен тем, что помимо ЦНС находится также и… на языке! Да, именно благодаря нему человек способен чувствовать тот самый вкус «умами», благодаря которому и началась история глутамата. Также, помимо обычных для таких рецепторов функций (LTP, участие в процессах запоминания и координации движений), mGluR4 обнаружен и в иммунных клетках – Т-хелперах. При активации этих рецепторов Т-хелпер снижает продукцию интерлейкина-17. Мыши, лишённые этого рецептора, были более восприимчивы к экспериментальным формам энцефаломиелита и рассеянного склероза.
mGluR6
Данный подвид глутаматного рецептора найден в больших количествах в сетчатке. Клетки, имеющие этот рецептор (в большинстве своём – ON-подтип биполярных клеток, у них рецептор располагается постсинаптически), участвуют в регуляции силы восприятия светового раздражителя. Некоторые мутации гена этого рецептора ведут к никталопии (народное название – «куриная слепота»), нарушению сумеречного зрения.
mGluR7
mGluR8
Об этом рецепторе известно мало. Однако, исходя из его близкого расположения к региону 7-й хромосомы, который подвергается делеции при синдроме Смита-Лемли-Опица, высказаны предположения о том, что его отсутствие влияет на неврологический статус пациента, в т.ч. обуславливая умственную отсталость, наблюдаемую при этом заболевании.
Как вы могли уже выяснить из прочтённого, рецепторы глутамата играют огромную роль в регуляции функционирования и развития нервной системы. Например, глутамат играет роль в гибели нейронов в условиях гипоксии – в таких условиях транспортёр глутамата (EAAT) просто не способен осуществлять обратный захват нейромедиатора в клетку. Таким образом, при массовой гибели нервных клеток количество высвободившегося глутамата растёт в геометрической прогрессии, вызывая эксайтотоксичное возбуждение в ещё живых нейронах, которые тоже могут умереть из-за этого.
Стоит рассказать об отечественных наркологах Крупицком и Гриненко и их изобретении – кетаминовой терапии алкоголизма. Само название звучит довольно интересно. Это в прямом смысле шоковая терапия – согласно теории авторов, после сильного психоэмоционального переживания, связанного с алкоголем, у пациента пропадёт тяга к алкоголю. Терапия проводится в три этапа:
В качестве заключения могу сказать, что глутаматэргическая система мозга – это одна из самых широкоспециализированных сигнальных систем в нашем мозге и нервной системе, и её роль действительно сложно переоценить.