что такое терапия off label
Off-label: просто о главном
В связи с участившимся упоминанием в СМИ термина «off-label use» будет не лишним вспомнить и разобраться, что он означает, где границы дозволенного в рекомендации лекарственных препаратов без показаний и как ситуацию трактует российское законодательство.
Что означает термин «off-label use»?
В переводе с английского — это использование лекарственного препарата «вне инструкции». То есть применение с медицинской целью не соответствует утвержденной государственными регулирующими органами инструкции по медицинскому применению.
Термин означает использование не по утвержденному показанию?
Не только. Термин имеет более широкое значение — применение по показанию, в лекарственной форме, дозе или схеме применения, в популяции пациентов, сведения о которых не содержит утвержденная инструкция по медицинскому применению препарата с актуальными на сегодняшний момент времени изменениями.
Например, в инструкции указан возраст «детям с 15 лет», при этом по рекомендации врача или провизора препарат приобретают для лечения ребенка более младшего возраста. Или рекомендации по приему антибиотика курсом в 5 дней вместо утвержденных и указанных в инструкции 3 дней. Или рекомендации по приему антигистаминных препаратов при бронхите. Или применение препарата для лечения ОРВИ, разрешенного только для его профилактики.
Почему это может быть опасно?
Это прежде всего опасно для самого пациента. Почему? Каждый лекарственный препарат перед одобрением его использования государственными регулирующими органами должен пройти определенные этапы — доклинические и клинические исследования I—III фазы. В ходе процедур оценивается как безопасность, так и эффективность применения препарата при данном заболевании (с указанием его формы или тяжести течения) именно у этой возрастной группы пациентов при введении в определенных схемах и дозах, из которых потом выбираются наиболее эффективные и безопасные. Это то, что касается оригинальных препаратов. Дженерики лишь повторяют их.
Важно понимать: для того, чтобы препарат был одобрен для медицинского применения, компания предоставляет большой объем информации, включая клинические данные о том, что он является эффективным и безопасным при его использовании по назначению. А это значит, что польза от применения препарата по показанию превышает потенциальные риски.
Кроме того, отсутствие показания в инструкции также может означать, что оно было отклонено (не одобрено) регулятором. А значит, риски превышают пользу от его применения.
Чем это грозит пациенту?
Нельзя ответить однозначно на этот вопрос. Как нельзя знать со 100%-ной уверенностью исходы клинического исследования по его завершению. Понятно, что off-label use серьезно повышает риски развития нежелательных побочных реакций, включая серьезные. Ведь в этой ситуации препарат «попадает в неисследованное поле».
Особое место занимает применение в педиатрии препаратов, разрешенных только во взрослой практике. Ребенок — это не маленький взрослый. Учитывая анатомические и физиологические возрастные особенности, нельзя рассчитать детскую дозу прямым пересчетом на килограмм массы тела, исходя из взрослой. Это может резко повысить риск развития токсического действия препарата.
Другой яркий пример — применение off-label ацетилсалициловой кислоты в качестве жаропонижающего препарата при ОРВИ у детей младше 15 лет. Это может привести к развитию угрожающего жизни синдрома Рея, при котором наблюдается токсическое поражение головного мозга и печени.
Каковы правовые аспекты этого явления? Предусмотрена ли в российском законодательстве ответственность фармацевта и провизора за рекомендацию препарата off-label? Об этом рассказывает директор юридической компании «Юнико-94», канд. юрид. наук Марат Милушин.
— Как трактует российское законодательство термин «off-label use»?
— Действующее российское законодательство «Об охране здоровья населения» и «Об обращении лекарственных средств» не оперирует понятием «off-label use» или его аналогом на русском языке.
Отметим, что согласно ч. 1 ст. 37 Федерального закона РФ № 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации» (в ред. от 03.07.2016) медицинская помощь организуется и оказывается в соответствии с порядками оказания медпомощи, обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями, а также на основе стандартов медпомощи, за исключением медпомощи, оказываемой в рамках клинической апробации.
При этом утвержденные Минздравом России обязательных для исполнения Порядки оказания медицинской помощи… не содержат запрета на применение лекарственных препаратов способами и в случаях, не предусмотренных инструкцией производителя по применению. В то же время во всех утвержденных Минздравом России Стандартах медицинской помощи… имеется примечание о том, что лекарственные препараты для медицинского применения, зарегистрированные на территории Российской Федерации, назначаются в соответствии с инструкцией по применению лекарственного препарата для медицинского применения и фармакотерапевтической группой по анатомотерапевтическо-химической классификации, рекомендованной ВОЗ, а также с учетом способа введения и применения лекарственного препарата.
Однако указанная выше норма закона не требует строгого применения Стандартов медицинской помощи, а указывает лишь на то, что медпомощь оказывается на основе стандартов. Утвержденные же Минздравом России обязательные для исполнения «Порядки оказания медицинской помощи…» не содержат указаний на обязательность строгого применения Стандартов медицинской помощи…
Таким образом, в явном виде четкий запрет на применение лекарственных препаратов способами и в случаях, не предусмотренными инструкцией производителя по применению (off-label use или off-label), действующим законодательством не установлен.
— Предусмотрена ли в российском законодательстве ответственность фармацевта/провизора за рекомендацию препарата off-label? Зависит ли ответственность аптечных работников от того, какого рода рекомендации были сделаны: по незарегистрированным показаниям, изменена возрастная группа, режим дозирования или популяция пациентов (например, препарат рекомендован детям)?
— Действующее законодательство об обращении лекарственных средств в явном виде не предусматривает ответственности фармработника за указанные в тексте вопроса рекомендации.
Отметим также, что, как правило, за редчайшим исключением фармработники дают рекомендации покупателям устно, что практически исключает возможность доказывания пострадавшими от неправильной рекомендации покупателями лекарственного препарата факта получения такой рекомендации от фармработника.
Обязанности фармацевтических работников определены в ч. 3 ст. 73 Федерального закона РФ № 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации» (в ред. от 3.07.2016). В соответствии с данной нормой закона фармацевтические работники обязаны:
Согласно ч. 3 ст. 69 Федерального закона РФ № 61-ФЗ от 12.04.2010 «Об обращении лекарственных средств» (в ред. от 3.07.2016) возмещение вреда, причиненного здоровью граждан вследствие применения лекарственных препаратов, осуществляется в соответствии с законодательством Российской Федерации.
Гражданско-правовая ответственность за причинение вреда здоровью предусмотрена нормами гл. 59 Гражданского кодекса РФ.
Частью 2 ст. 118 Уголовного кодекса РФ за причинение тяжкого вреда здоровью по неосторожности, совершенное вследствие ненадлежащего исполнения лицом своих профессиональных обязанностей, предусмотрено наказание в виде ограничения свободы на срок до четырех лет, либо принудительных работ на срок до одного года с лишением права занимать определенные должности или заниматься определенной деятельностью на срок до трех лет или без такового, либо лишение свободы на срок до одного года с лишением права занимать определенные должности или заниматься определенной деятельностью на срок до трех лет или без такового.
Таким образом, гражданско-правовая или уголовная ответственность фармацевтического работника в указанных в тексте вопроса случаях может наступить только при причинении вреда здоровью неправильным применением лекарственного препарата по рекомендации фармработника. При этом подлежит доказательству как сам факт наличия такого рода рекомендации, так и прямая связь между такой рекомендацией и причинением вреда здоровью гражданина.
Доказательная и экспериментальная терапия COVID-19
Уже почти 5 месяцев мир живет в новой реальности, обусловленной выявлением новой болезни — COVID-19. Несмотря на установленные ВОЗ (спустя почти 3 месяца от момента выявления первых случаев) 24 марта 2020г критерии определения COVID-19, неспецифичность и гетерогенность симптомов при COVID-19 затрудняют диагностику и дифференциальную диагностику; лабораторные тесты и компьютерная томография не обладают 100% диагностической точностью именно для COVID-19. В научных публикациях из разных стран мира COVID-19 представлен значительной вариабельностью течения: от ассимптомного до тяжелой полиорганной недостаточности и смерти.
Соответственно возникают вопросы. Возможно ли адекватное лечение болезни с не очень четкими критериями установления диагноза? Что считать эффективным лечением? Какое лечение необходимо- симптоматическое, направленное на уничтожение вируса в организме и то и другое? Надо ли лечить бессимптомное течение болезни? Что является доказательством эффективного лечения COVID-19? Ответов на эти вопросы пока нет.
Что считать доказательством эффективности лечения
На протяжении последних 50 лет к сильным доказательствам эффективности лечения относили (в самом общем виде) преимущества одного вида лечения над другим, полученные в крупных рандомизированных клинических исследованиях( РКИ), к слабым – данные небольших наблюдательных исследований. Преимущества и эффект оценивали по так называемым «истинным» и «суррогатным» точкам. К первичным истинным оценкам относят снижение числа смертей, снижение частоты и тяжести осложнений, к вторичным — облегчение симптомов заболевания. К суррогатным конечным точкам относят данные лабораторных и инструментальных исследований, при наличии доказательств их связи с истинными критериями. Несмотря на то, что РКИ не лишены недостатков, они считаются золотым стандартом доказательности эффективности лечения, и их обычно проводятся для испытания новых лекарственных препаратов или для лечения заболеваний(состояний) препаратами, не зарегистрированных именно для оцениваемого заболевания (то есть применение препарата Off label).
На начальном этапе лечения COVID-19 лекарственных препаратов, созданных именно для лечения данного заболевания, просто не было. И в Китае (как стране, которая первой начала лечение нового заболевания) применялись как лекарственные препараты, которые могли помочь теоретически (исходя из предположения воздействия на вирус и/или облегчения симптомов болезни), так и методы традиционной китайской медицины. Врачи и пациенты оказались в ситуации, когда на фоне критического состояния пациентов, все были готовы принять даже не слабые доказательства, которые можно получить в обсервационных или регистровых исследованиях, а гипотезы о возможном эффекте. Так, на фоне применения «терапии отчаяния» в научных журналах стали публиковаться статьи о результатах лечения. Со временем статей становится все больше и больше и далеко не все из них представляют надежную информацию. Только один пример. В марте 2020г в журнале Int J Antimicrob Agents появилась онлайн публикация[1], в которой группа французских врачей на основании результатов лечения 26 пациентов, пришла к выводу, что лечение гидроксихлорохином в сочетании с азитромицином приводит к уменьшению /исчезновению вирусной нагрузки у пациентов с COVID-19, и способствует выздоровлению. В последующем выяснилось, что 6 пациентов, которым не стало лучше, были исключены из анализа. 3 апреля журнал, в котором была опубликована статья, разместил на сайте заявление Международного Общества Антимикробной Терапии (ISAC), в котором было сказано: ISAC считает, что статья не соответствует ожидаемому стандарту. И хотя ISAC признает, что важно помогать научному сообществу и быстро публиковать новые данные, это не должно быть причиной ухудшения качества научных исследований[2]. 15 мая 2020 г глава Федерального медико-биологического агентства В.И. Скворцова сообщила на брифинге [3] о результатах лечения мефлохином более чем 420 пациентов в соответствии с методическими рекомендациями Минздрава России. Применение препарата со слов В.И. Скворцовой на фоне среднетяжелого течения COVID-19 позволяет достичь стабилизации или устойчивого улучшения не менее чем в 70% случаев. Является ли такое сообщение доказательством эффективности? Конечно, нет. Во-первых, что значит улучшение? Критерии оценки состояния должны быть четко указаны при проведении исследования, нельзя в качестве доказательства просто сказать «состояние улучшилось». Во-вторых, нельзя исключить, что к этому времени состояние пациентов улучшилось бы и без лечения данным препаратом, на фоне применения симптоматической терапии другими препаратами. В третьих, для того, чтобы дать оценку эффекта от применения препарата протокол, подробная характеристика пациентов и результаты исследования должны быть доступны для широкого обсуждения. Иначе, это не доказательства, а вера в слова.
На текущий момент в мире нет доказательств эффективности применения данной группы препаратов (хлорохин, гидроксихлорохин) для лечения COVID-19, исследования продолжаются. Обзоры литературы, проведенные в апреле 2020 года, не выявили убедительных данных, указывающих на снижение летальности или уменьшение числа осложнений в результате применения гидроксихлорохина и хлорохина[4,5]. Однако РКИ еще не завершены. Возможно, препарат даст положительный эффект (пока не достаточно ясно, что считать положительным эффектом) в группе пациентов с определенными клиническими и/или демографическими характеристиками, оказавшись совершенно бесполезным или даже вредным у пациентов с другими характеристиками. FDA (США) выдало разрешение на применение препаратов в чрезвычайных ситуациях, что не означает одобрения для широкого использования в лечении COVID-19.
Off label use: фармакотерапия без правил?
Посмотреть вебинар можно здесь.
Офф-лейбл (англ. off-label, от off — за пределами, label — этикетка, инструкция) — использование лекарственных средств по показаниям, не утверждённым государственными регулирующими органами, не упомянутым в инструкции по применению.
ЧП в Московском НИИ глазных болезней им. Гельмгольца, по факту частичной потери зрения пациентами которого было возбуждено уголовное дело, вновь напомнило о существовании в российской и мировой врачебной практике проблемы off label. Главным стал вопрос, почему медики использовали предназначенный для онкологического применения препарат «Авастин» в офтальмологии.
«Авастин», зарегистрированный в 2004 году FDA США для онкологического применения, вскоре вошел в арсенал американских офтальмологов. А сегодня уже официально признан на уровне Минздравов ряда стран, используется off label в частных клиниках США и Евросоюза и, по словам главного врача НИИ им. Гельмгольца Марины Харлампиди, даже рекомендован ВОЗ для лечения офтальмологических заболеваний.
Классификация назначения препаратов off-label
• использование ЛП в возрасте, официально не разрешённом в инструкции по медицинскому применению;
• назначение ЛС по незарегистрированным показаниям;
• использование ЛП при наличии противопоказаний к его применению;
• использование в дозах, отличных от указанных в инструкции данного ЛП,
• нарушение кратности и длительности применения;
• назначение неблагоприятных лекарственных комбинаций; применение по неоговоренному в инструкции пути введения ЛП
Согласно требованиям закона в странах ЕС и США фармацевтические компании обязаны представить план управления рисками для каждого нового препарата.
Меры по снижению рисков при применении ЛС
— Мед. руководства для специалистов и пациентов
— Разъяснение условий применения ЛС
— Ограничение числа назначаемых ЛС
— Информированное согласие
— Учет врачей, назначающих ЛС
— Учет пациентов, получающих ЛС
— Мед. руководства для специалистов и пациентов
— Разъяснение условий применения ЛС
— Ограничение числа назначаемых ЛС
— Информированное согласие
— Учет врачей, назначающих ЛС
— Учет пациентов, получающих ЛС
В FDA основное внимание уделяется регулированию утверждения отпускаемых по рецепту лекарств, а не регулированию практики назначения лекарств врачами. Поэтому использование медикаментов по показаниям, отличных от формально зарегистрированных, допустимо в медицинской клинической практике. Полное и окончательное использование препарата редко проявляется во время первоначального одобрения или маркетинга FDA. Открытие и клиническое принятие новых применений для продаваемых лекарств или для исследуемых лекарств часто предшествует одобрению FDA такого использования.
Меры, принимаемые для снижения рисков в России
— Образовательные программы
— Информационные письма, предоставляемые специалистам и в РЦ МБЛС
— Предложения по внесению изменений в инструкцию (для принятия административных решений)
— Получение информированного согласия пациента
— Подготовка рекомендаций по обеспечению безопасности применения ЛС (Варениклин, Сибутрамин, Золпидем)
— Ограничение поставок (только в стационары и отдельные аптеки)
Информирование и консультирование пациента в аптеке
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2013
Антипсихотики off-label №04 2013
Санкт-Петербургский государственный университет
Резюме. Обзор литературы посвящен проблеме применения атипичных антипсихотиков off-label. Проводится анализ возможности и целесообразности, в том числе, с позиции соотношения риск/польза использования нейролептиков второй генерации в терапии тревожных, обсессивно-компульсивных, депрессивных, соматоформных расстройств, расстройств личности и пищевого поведения, деменции, бессоннице, при психических расстройствах у детей. Приводится доказательная сила эффективности различных препаратов (арипиразола, рисперидона, оланзапина, кветиапина, зипрасидона).
Ключевые слова: психические расстройства, терапия, нейролептики второй генерации.
N.N.Petrova, M.V.Dorofeikova
Saint Petersburg State University
Summary. The literature review deals with the off-label use of atypical antipsychotics. The possibilities and expediency, including those in the context of a risk/benefit use of second-generation neuroleptics in the therapy of anxiety, obsessive-compulsive, depressive, somatoform, personality, and eating disorders, dementia, insomnia, in mental disorders in children are analyzed. There is evidence for the efficacy of different drugs (aripiprazole, risperidone, olanzapine, quetiapine, and ziprasidone).
Key words: mental disorders, therapy, second-generation neuroleptics.
Традиции отечественной психиатрической школы предполагают необходимость проведения лечения на основании тщательного соотнесения клинических особенностей заболевания и спектров психотропной активности нейролептиков [1, 2, 6, 7].
Было принято различать профили психотропной активности нейролептиков по выраженности преимущественно седативного, селективного или глобального антипсихотического, активирующего (дезингибирующего), депрессогенного, нейротропного действия. В соответствии с концепцией широкого и узкого спектра психотропного действия выделили препараты, которые эффективны при полиморфных, генерализованных психопатологических синдромах (галлюцинаторно-параноидных, кататоно-гебефренных и др.), а также препараты, которые способствуют редукции ряда более изолированных психопатологических синдромов [9].
Появление нейролептиков II поколения привело к условному выделению традиционных (классических) нейролептиков и атипичных антипсихотиков. D.Naber и М.Lambert (2009 г.), размышляя о вопросах систематики нейролептиков и анализируя эволюцию терминологии, отметили, что название «атипичные» было связано с предполагаемым отсутствием двигательных побочных эффектов. Однако было установлено, что и эти препараты в высоких дозировках вызывают экстрапирамидные нарушения, и понятие атипичности стало носить скорее количественный, чем категориальный характер. Последние исследования, по мнению авторов, показали, что подобный принцип разделения «псевдокатегоричен» [137].
Вместе с тем формируется приоритетность применения атипичных антипсихотиков по сравнению с традиционными нейролептиками, что обусловлено рядом факторов. Так, например, среди недостатков традиционной нейролептической терапии шизофрении выделяют резистентность к монотерапии, доходящую до 25–30% случаев, низкую эффективность коррекции негативных расстройств, высокий риск побочных эффектов, в частности нейролептических депрессий, широкий спектр неврологических, соматовегетативных, эндокринных нарушений [3, 5].
Бимодальный спектр действия на дофаминовые и серотониновые рецепторы указывает на перспективность использования атипичных антипсихотиков для преодоления резистентности к традиционным нейролептикам, коррекции негативных и когнитивных расстройств.
Из других преимуществ в ТоПеГзоп (1997 г.) отмечены особенности их фармакокинетики: быстрое достижение пика концентрации в крови (через 5 ч после поступления в организм); наличие пролонгированного эффекта (период полувыведения варьирует от 21 до 54 ч); возможность титрования дозы, которая достигается благодаря параллелизму между принимаемой дозой препарата и концентрацией его в плазме крови; безопасность применения в сочетании с другими психотропными и сомато-тропными препаратами [4].
В настоящее время получила распространение точка зрения, согласно которой все нейролептики различаются главным образом по спектру побочных эффектов и принципом выбора терапии должно служить соотношение «риск/польза». Предполагается, что это соотношение у атипичных антипсихотиков более благоприятно по сравнению с нейролептиками I поколения. Однако вопрос различий по этому параметру между препаратами внутри группы нейролептиков новой генерации, как, впрочем, и в отношении типичных нейролептиков, остается открытым.
Данный обзор посвящен анализу возможности и целесообразности применения атипичных антипсихотиков off-label – не по показаниям, в том числе с позиции соотношения «риск/польза». Следует отметить, что этот вопрос рассматривается в литературе последних лет именно в отношении нейролептиков II генерации.
Официальные показания для нейролептической терапии весьма ограниченны. Так, нейролептики одобрены Управлением по контролю пищевых продуктов и лекарств в США (FDA) для лечения шизофрении, биполярного аффективного расстройства (БАР) и некоторые из них – депрессии. При этом, например, 2-летнее исследование применения кветиапина в психиатрических больницах показало, что лишь 1/4 пациентов, получавших препарат, имели диагноз, при котором он одобрен, и только 1/3 пациентов получали его в стандартных дозах. Чаще всего кветиапин использовали при депрессии и в наркологической практике [154].
В зарубежной литературе имеются указания, что наиболее часто среди атипичных антипсихотиков применяются off-label рисперидон, кветиапин и оланзапин [13, 40, 91], а, например, в США, по данным 2009 г., – кветиапин и рисперидон [154].
В качестве мишеней применения нейролептиков помимо психозов выделяют бессонницу, тревогу, обсессивно-компульсивное расстройство (ОКР), возбуждение и другие поведенческие расстройства [123]. Высказано мнение, что наиболее распространенные психические расстройства для применения антипсихотиков off-label – посттравматическое стрессовое расстройство (ПТСР) и «малая депрессия» [115]. Данные канадских, британских, французских, австралийских, турецких, немецких, новозеландских и итальянских психиатров говорят об опыте применения атипичных антипсихотиков при тревоге [24, 40, 67, 91, 185], синдроме дефицита внимания и гиперактивности – СДВГ [19, 91], расстройствах личности – РЛ [185], депрессии [74, 91, 185], деменции [13, 81, 144, 166, 171, 198], расстройствах пищевого поведения – РПП [82].
Анализ использования атипичных антипсихотиков off-label с помощью англоязычных материалов PubMed, Embase, PsycINFO, CINAHL (Cumulative Index to Nursing and Allied Health Literature), Cochrane DARE (Database of Abstracts of Reviews of Effects) и Cochrane CENTRAL (Cochrane Central Register of Controlled Trials) на примере 170 статей, опубликованных до мая 2011 г. включительно, показал, что атипичные антипсихотики применялись при тревожном расстройстве, СДВГ, деменции и выраженной ажитации у пожилых, депрессии, РПП, бессоннице, ОКР, ПТСР, РЛ, зависимостях и синдроме Туретта [123].
Данные литературы свидетельствуют об опыте применения при тревожных расстройствах оланзапина [28, 155], кветиапина [14, 27, 68, 94, 104, 109, 111, 132, 134, 175, 190], рисперидона [44, 150, 156, 173] и зипрасидона [121].
В одном из плацебо-контролируемых исследований оланзапин оказался эффективнее плацебо [28], в 2 других – кветиапин не отличался от плацебо в терапии социальной фобии [68, 190].
Кветиапин в дозе 50 или 150 мг/сут оказался схожим по эффективности с пароксетином в дозе 20 мг/сут при терапии генерализованного тревожного расстройства (ГТР) в течение 8 нед, но при этом лечение кветиапином сопровождалось меньшей частотой побочных эффектов со стороны половой сферы [27]. Показано, что 150 или 300 мг/сут кветиапина равны по эффективности 10 мг/сут эсциталопрама в терапии ГТР в течение 8 нед [134]. При поддерживающей монотерапии кветиапином наблюдалось достоверное снижение риска рецидива эпизодов генерализованной тревоги [109].
Ряд активно контролируемых исследований, базировавшихся на наличии терапевтического ответа (снижение общего показателя по шкале тревоги Гамильтона – НАМ-А минимум на 50%), был направлен на оценку эффективности комбинированной терапии нейролептиками и различных лекарственных средств. Обнаружено, что аугментация кветиапином и кветиапином пролонг антидепрессивной терапии препаратами группы селективных ингибиторов обратного захвата серотонина (СИОЗС), в частности пароксетином, не дает преимуществ в преодолении терапевтической резистентности при ГТР [14, 111, 175].
В 8-недельном рандомизированном плацебо-контролируемом исследовании установлена эффективность сочетанной терапии рисперидоном в малых дозах и пароксетином при паническом расстройстве [156].
Результаты применения атипичных антипсихотиков при ПТСР противоречивы. Есть данные, которые свидетельствуют об эффективности рисперидона [29, 89, 136, 149, 158] и оланзапина [48, 180]. Анализ 5 работ, которые включали от 19 до 65 пациентов, получавших лечение в течение 5–16 нед [29, 89, 158, 162, 180], выявил умеренно значимую эффективность рисперидона в дозе 0,5–3 мг/сут (4 исследования) и оланзапина (15 мг/сут). Соответственно, относительный риск составил 6,47 (c 95% доверительным интервалом – ДИ 0,32–12,61) и 12,13 (95% ДИ 0,97–23,29), суммарно 7,79 (95% ДИ 2,40–13,17) [123]. Отмечена эффективность рисперидона в отношении отдельных симптомов ПТСР (раздражительности и навязчивых мыслей) [136].
Наряду с этим в метаанализе 2011 г. выявлен некоторый положительный эффект рисперидона и кветиапина, но не оланзапина [11]. В исследовании M.Butterfield и соавт. также было установлено, что оланзапин по эффективности не отличался от плацебо [48]. Небольшие (от 15 до 94 пациентов с ПТСР) исследования, в основном посвященные применению рисперидона, дали неоднозначные результаты [29, 89, 90, 136, 148, 149, 158, 162].
Метаанализы показали, что кветиапин и рисперидон весьма эффективны в качестве комбинированной терапии ОКР [123, 174]. Однако в отдельных работах повышение вероятности терапевтического ответа на основании результатов обсессивно-компульсивной шкалы Йеля–Брауна (Yale Brown Obsessive Compulsive Scale, Y-BOCS) достигло уровня статистической значимости для рисперидона, но не для кветиапина и оланзапина [37, 176].
Восемь работ, опубликованных с 2006 по 2011 г., 5 из которых – плацебо-контролируемые, свидетельствуют об эффективности аугментации кветиапином или рисперидоном антидепрессивной терапии циталопрамом либо ИОЗС: соответственно, 2,36 (95% ДИ 0,85–6,57), 3,92 (95% ДИ 1,27–12,13) [61, 63, 65, 114, 123, 125, 129, 194, 195]. Вместе с тем число пациентов, включенных в эти исследования, было невелико – от 18 до 66.
Применение при ОКР кветиапина в сочетании с СИОЗС
(в отличие от кломипрамина) оказалось эффективным, по данным Y-BOCS [65]. В сочетании с ИОЗС кветиапин показал себя как более эффективный препарат по сравнению с зипрасидоном (80 и 44,4% улучшение по шкале Y-BOCS соответственно) [164]. Следует отметить, что кветиапин эффективен как при лечении ОКР, так и ГТР: при ГТР кветиапин повысил вероятность ответа на терапию на 26% по сравнению с плацебо (минимум 50% улучшение по НАМ-А), при ОКР – в 3,9 раза (25–35% улучшение по шкале Y-BOCS).
При сравнении разных атипичных антипсихотиков в лечении ОКР было выяснено, что терапевтический эффект монотерапии оланзапином или рисперидоном существенно не различается [41].
В австралийском исследовании на примере 154 больных ОКР было показано, что 60,4% получали психотропную терапию, из них 59,1% – СИОЗС, а прием антипсихотических препаратов был ассоциирован с наличием хульных мыслей [123].
В метаанализе 2006 г., направленном на оценку возможностей применения атипичных антипсихотиков при большой депрессии, было выявлено отсутствие различий между атипичными антипсихотиками и плацебо в сочетании их с СИОЗС при длительности лечения 8 нед. В некоторых исследованиях, впрочем, атипичные антипсихотики способствовали более быстрой редукции депрессивной симптоматики (2–4 нед) [174].
В метаанализах Papakostas 2007 и 2009 гг. было выявлено положительное влияние аугментации атипичными антипсихотиками по числу ответов на терапию и достижению ремиссии при отсутствии различий в эффективности между отдельными препаратами (оланзапином, кветиапином, рисперидоном, арипипразолом) [138, 151]. Есть данные, что монотерапия кветиапином существенно увеличивает период до следующего эпизода депрессии [22].
С 2006 по 2011 г. вышло 26 статей о применении атипичных антипсихотиков при депрессии в качестве аугментации антидепрессивной терапии СИОЗС у пациентов с резистентной депрессией [30, 34, 35, 50, 72, 77, 80, 110, 113, 124, 126, 130, 132, 139, 157, 203]. При аугментации рисперидоном была выявлена большая дезактуализация суицидных мыслей по сравнению с монотерапией антидепрессантами [157]. Арипипразол в качестве аугментации антидепрессивной терапии позволял добиться терапевтического ответа (достоверная динамика по шкале Монтгомери–Асберга) [113].
Данные активно контролируемых исследований свидетельствуют о значительном улучшении состояния по шкале Монтгомери–Асберга у больных с депрессией, получавших сочетанную терапию оланзапином и флуоксетином, по сравнению с монотерапией одним из этих препаратов [188]. Добавление кветиапина в терапевтическую схему к пароксетину или венлафаксину усиливало антидепрессивный эффект (по данным шкалы депрессии Гамильтона – HAMD-17) [97]. Восьминедельное исследование эффективности зипрасидона в качестве аугментации терапии сертралином продемонстрировало максимальное улучшение состояния по общей клинической шкале CGI-S и шкале Монтгомери–Асберга при назначении 160 мг зипрасидона (по сравнению с 80 мг зипрасидона либо монотерапией сертралином) [71]. Впрочем, по HAMD-17 и HAM-A значительных различий найдено не было.
Данные литературы свидетельствуют о достижении ремиссии депрессии через 4–8 нед при сочетанной терапии антидепрессантами и атипичными антипсихотиками [80, 110, 124, 130, 132, 203]. Вероятность ремиссии (по HAMD) при применении антипсихотика была определена как 2,76 (95% ДИ 1,21–6,28) для кветиапина и 2,10 (95% ДИ 1,43–3,09) для рисперидона. Вероятность ответа на терапию (минимум 50% снижение по HAMD) составила 2,30 (95% ДИ 1,35–3,92) для кветиапина и 1,50 (95% ДИ 1,20–1,87) для рисперидона [123].
Ремиссия (уровень депрессии от 8 до 10 баллов по шкале Монтгомери–Асберга в зависимости от исследования) была зафиксирована в 8 исследованиях комбинированной терапии [30, 34, 35, 72, 77, 110, 126] – от 97 до 493 обследованных больных. Доказана эффективность арипипразола и кветиапина: арипипразол против плацебо – 1,57 (95% ДИ 1,24–2,00) и кветиапин против плацебо – 1,24 (95% ДИ 0,82–1,88) [123].
В ряде исследований, которые включали от 310 до 723 пациентов, подтверждена эффективность монотерапии депрессии кветиапином: в течение 6–9 нед терапии вероятность достижения ремиссии (по шкале Монтгомери–Асберга) составила 1,43 (95% ДИ 1,07–191) по сравнению с плацебо – 1,49 (95% ДИ 1,23–1,81) [21, 23, 39, 59, 123, 196]. Кветиапин оказался более эффективным по сравнению с препаратами лития при терапии в течение 56 дней (по шкале депрессии Гамильтона, Монтгомери–Асберга и Wildlocher Psychomotor Retardation Scales) [69].
Обзор 4 рандомизированных контролируемых исследований 2011 г. по применению антипсихотиков при соматоформном расстройстве показал эффективность сульпирида при диспепсии и неэффективность антипсихотиков при дисморфофобии [62].
Метаанализ 2007 г. не смог обнаружить преимущества рисперидона или оланзапина перед плацебо в лечении кокаиновой зависимости [123]. Данные плацебо-контролируемых исследований длительностью 8–12 нед [88, 117, 159, 178, 181] показали одинаковую с плацебо эффективность оланзапина [88, 107, 159] и рисперидона [83, 120], а в работе Levin и соавт. рисперидон оказался неэффективным [116].
Опыт лечения алкоголизма с помощью атипичных антипсихотиков говорит о том, что наиболее частым результатом является достижение воздержания от алкоголя. Длительность воздержания от алкоголя и число пациентов, достигших полного воздержания от употребления алкоголя, не различались при лечении налтрексоном и арипипразолом [128]. Вместе с тем в плацебо-контролируемом исследовании было показано, что терапия арипипразолом не способствовала увеличению периода воздержания от алкоголя [17]. Однако аугментация кветиапином терапии налтрексоном оказалась эффективной [84].
Данные метаанализа 2006 г. о нейролептической терапии синдрома Туретта свидетельствуют о преимуществах рисперидона перед плацебо. Неоднозначные данные были получены об эффективности зипрасидона [174]. Описательные работы о лечении тиков (в возрасте до 18 лет) с помощью арипипразола свидетельствуют об улучшении состояния, однако довольно значительная часть пациентов (8 из 37 и 6 из 24) были вынуждены прервать курс лечения в связи с побочными эффектами [47, 199].
Рисперидон, как антипсихотик с антисеротониновым действием, в средней дозе 2,5 мг/сут показал положительный эффект при лечении синдрома Туретта в open-label-исследованиях и двойных слепых плацебо-контролируемых исследованиях, в частности Guy Chouinard, на 48 пациентах [16, 45, 46, 53, 54, 66, 76, 122, 165]. Так, 60,8% пациентов по сравнению с 26,1% пациентов, получавших плацебо, обнаружили улучшение общего функционирования. Влияния рисперидона на дистонию, дискинезии, акатизию обнаружено не было, притом что гипокинезия и тремор (в случаях его изначальной выраженности) наросли.
Особой проблемой является ограниченное применение нейролептической терапии у детей. Halloran и соавт. изучали паттерны назначения атипичных антипсихотиков частно застрахованным детям в США в возрасте от 2 до
18 лет в период 2002–2005 гг. и определили, что частота назначения нарастает (с 7,9 до 9,0 на 1 тыс. случаев). Мальчикам назначали почти в 2 раза больше препаратов, чем девочкам. Среди причин назначения преобладали поведенческие расстройства (67%), расстройства настроения (65%) и тревожные расстройства (43%), причем 75% детей имели более одного психиатрического диагноза. Чаще всего пациентам детского возраста назначали рисперидон (53%) и кветиапин (33%) [87].
Небольшое количество работ посвящено лечению антипсихотиками СДВГ. В одном из них все пациенты ответили на терапию рисперидоном, притом что на плацебо ответили 77% пациентов [20]. У детей с коморбидными СДВГ и умеренной умственной отсталостью рисперидон по сравнению с метилфенидатом оказался более эффективным [55]. Результаты 2 исследований, посвященных применению арипипразола при СДВГ в сочетании с БАР, не показали улучшения [123].
Клинический случай
Больная М. 55 лет, замужем, несколько лет не работает.
В течение примерно 10 лет постоянно безуспешно посещает различных специалистов-дерматологов в связи с убежденностью «заражения паразитами». Предъявляет жалобы на ощущение «передвижения насекомых» под кожей, неровность кожных покровов. Детально описывает размеры, строение, пути передвижения, жизненный цикл паразитов. Регулярно сдает для проведения микроскопического исследования «вещественные доказательства» – «частицы насекомых» представляются в лаборатории как личинки, яйца или продукты жизнедеятельности паразитов.
Занимается «вытравливанием» насекомых из организма. «Борьба» с паразитами включает такие методы самолечения, как механическое воздействие, едкие жидкости. Лицо, шея, плечи, грудь пациентки имеют выраженные дефекты кожного покрова (глубокие обезображивающие шрамы). Обрабатывает химическими веществами одежду, белье.
Таким образом, в клинической картине у пациентки дерматологической практики представлены монотематический паранойяльный зоопатический бред, тактильный галлюциноз, «симптом спичечного коробка», патомимия – кожные аутодеструктивные проявления, что соответствует дерматозойному бреду – инволюционной паранойе.
Назначен рисперидон (Торендо). Начальная доза составила 2 мг/сут, на 2-й день дозу повысили до 4 мг/сут. На фоне терапии рисперидоном (Торендо) в течение месяца наблюдались улучшение социальной адаптации, снижение актуальности патологических идей, редукция соматосенсорных феноменов восприятия.
Данный случай иллюстрирует применение рисперидона (Торендо) в психосоматике в режиме off-lable.
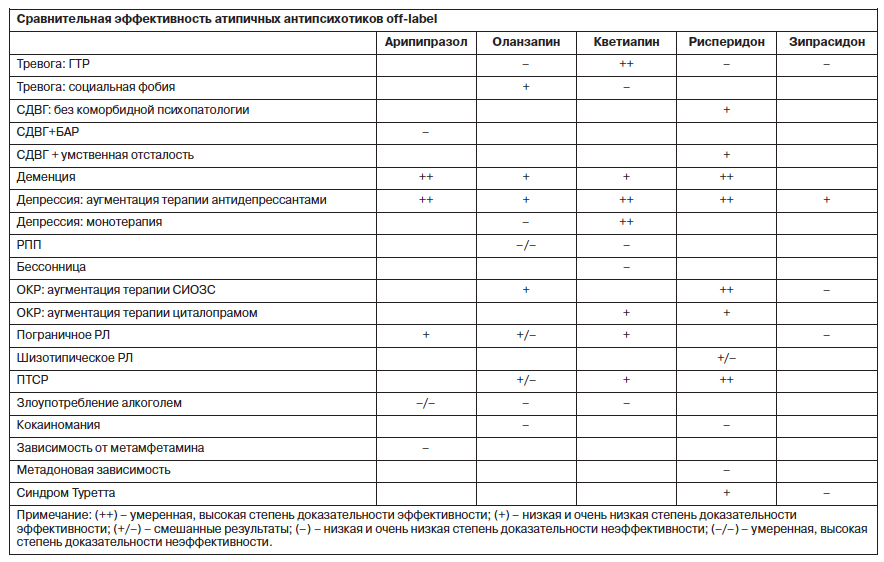
Доказательная сила эффективности различных препаратов приведена в таблице [123].
Таким образом, арипипразол, оланзапин и рисперидон оказывают не выраженный, но статистически значимый эффект в лечении психотических расстройств, возбуждения и поведенческих симптомов при деменции, однако следует учитывать значительный риск побочных эффектов. Зипрасидон не имеет достаточной доказательной базы для применения его off-label, за исключением депрессии. Умеренной силы доказательная база говорит об эффективности арипипразола, кветиапина и рисперидона в качестве аугментации антидепрессивной терапии: вероятность терапевтического ответа возрастает в 1,5–2 раза. Данных о применении оланзапина недостаточно, но они обнадеживают. Оланзапин продемонстрировал достаточную эффективность в терапии социальной фобии и ОКР. Умеренная доказательность наблюдается в отношении эффективности монотерапии депрессии кветиапином, аугментации терапии ОКР рисперидоном. Доказана эффективность и безопасность применения кветиапина при ГТР, рисперидона при ПТСР. Отсутствуют убедительные данные об эффективности атипичных антипсихотиков при РЛ, диссомнии, РПП и аддикции.