что значит атом в возбужденном состоянии
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Основное и возбужденное состояние атома
Как известно, атомы могут вступать в химические реакции с другими атомами, с образованием химических связей, путем отдачи/принятия своих/чужих электронов, которые называются валентными (см. Валентность).
В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице (см. Таблицу электронных конфигураций атомов химических элементов по периодам.
В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Рассмотрим основное и возбужденное состояние атома на конкретных примерах.
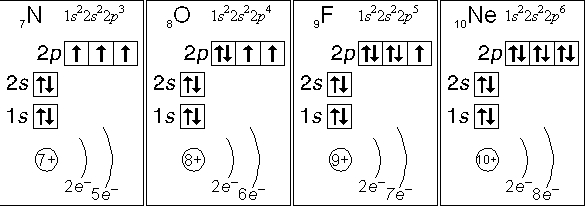
Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона.
Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы «перескакивать» спаренные электроны с орбиталей с меньшей энергией.
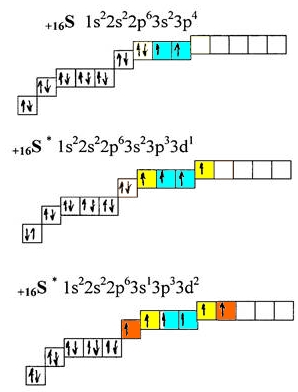
Рис. Возбужденное состояние атома серы.
В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Возбужденные атомы: 2. Быстротечная жизнь возбужденных атомов
Вверху: так в упрощенной картине обычно изображается излучение фотона при переходе атома из возбужденного состояния в основное.
Внизу: энергия излученного фотона равна разнице энергий электрона в возбужденном и основном состоянии. Поскольку возбужденных состояний много, водород может излучать свет на разных, но фиксированных длинах волн. Изображение с сайта hemi.nsu.ru
Самый главный факт про возбужденные состояния атомов таков:
 | возбужденные состояния неустойчивы. |
Раз атом можно возбудить каким-то воздействием, вложив в него дополнительную энергию, то возможен и обратный процесс — атом может сбросить эту энергию (например, излучив фотон) и вернуться в основное состояние. Поэтому всякое возбужденное состояние атома имеет какое-то определенное время жизни; вот про эти времена жизни возбужденных атомов мы и поговорим.
Мы уже договорились, что мы не будем пытаться по-настоящему вычислить длительность того или иного квантового процесса. Даже студенты-физики начинают этим заниматься лишь на третьем курсе университета. Мы лишь возьмем на вооружение главные руководящие правила, которые помогут нам почувствовать характерные временные масштабы явлений.
Для нашего класса явлений — возбужденный атом излучает фотон и возвращается в основное состояние — опорное время составляет наносекунды. Примерно столько времени живут возбужденные состояния атомов, когда излучению фотона не мешают ни квантовые особенности внутри атома, ни внешние условия. В университетском курсе квантовой механики расчет таких процессов начинают с простейшего классического примера — возбужденного состояния атома водорода, в котором электрон находится на p-орбитали (состояние 2P). Такой электрон может легко излучить фотон и спуститься в основное состояние (1S) — никаких особых препятствий для этого нет. Время жизни такого возбужденного состояния как раз составляет τ (2P → 1S) ≈ 1,6 нс.










