что значит экспрессия клеток опухоли
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
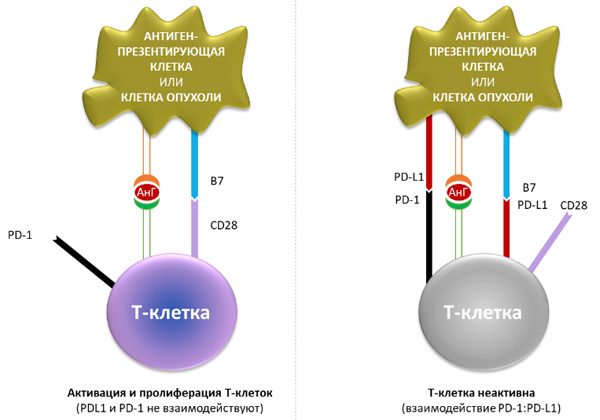
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
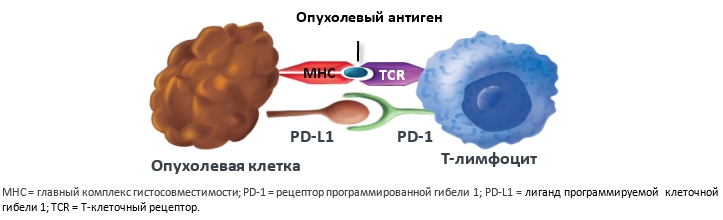
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
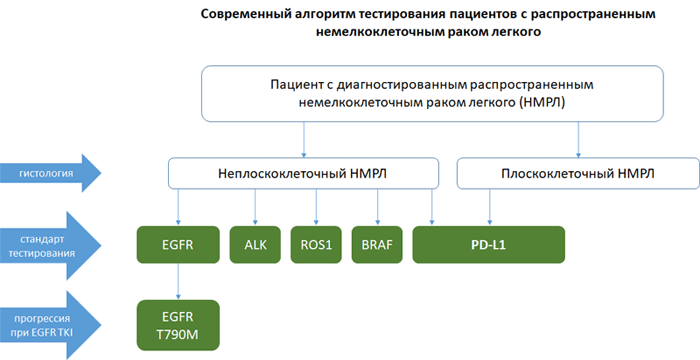
НМРЛ: методы определения экспрессии PD-L1
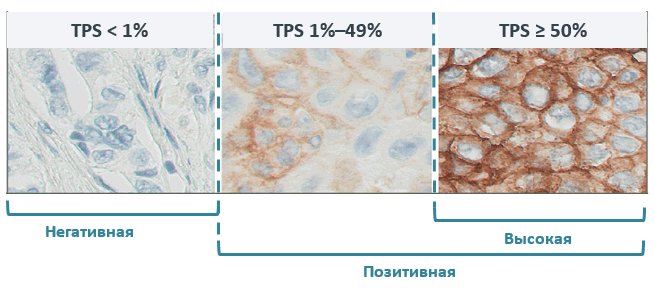
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
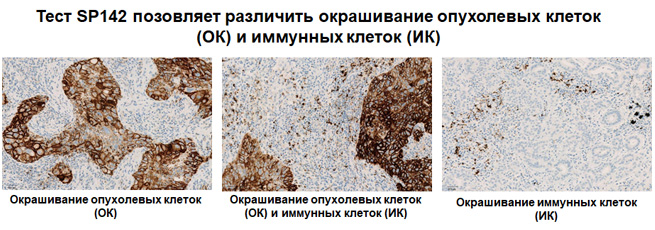
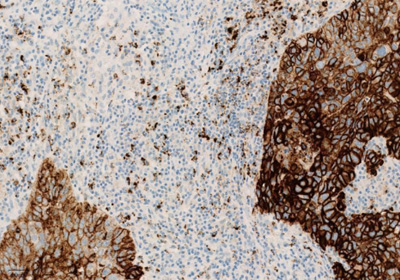
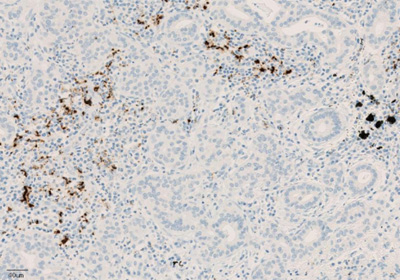
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Морфологическая диагностика опухолей: сдвиг в сторону молекулярно-генетического анализа
Александр Иванцов, кандидат медицинских наук,
Максим Клещёв, кандидат медицинских наук,
Екатерина Кулигина, кандидат биологических наук,
НМИЦ онкологии им. Н. Н. Петрова МЗ РФ (Санкт-Петербург)
«Природа» №6, 2018
Диагностика онкологических заболеваний начинается с морфологического анализа фрагмента пораженного органа, который зафиксирован в формалине, обезвожен в спиртах восходящей плотности и заключен в парафин. Данная процедура позволяет выполнить срез толщиной 3 мкм и поместить его на стекло, затем окрасить ядра клеток и другие базофильные структуры ярко-синим щелочным красителем гематоксилином, а цитоплазму — розовым кислым красителем эозином. Окрашивание позволяет четко визуализировать основные элементы клетки. Затем сопоставляют микроскопический «пейзаж» исследуемого образца с эталонным, на котором зафиксирована характерная для конкретной анатомической области гистологическая структура. О присутствии инвазивного неопластического процесса свидетельствуют утрата типичной гистоархитектоники и клеточных молекулярных структур, наличие полиморфных неорганизованных клеток (рис. 1).
Рис. 1. Рак толстой кишки: утрата типичной гистологической структуры в ходе неопластического процесса
Помимо установления самого факта злокачественной трансформации для назначения индивидуализированной терапевтической схемы важно как можно раньше определить гистологический тип опухоли и оценить стандартные маркеры агрессивности (степень дифференцировки, митотическая активность и т. д.). В пределах одного органа патологический процесс может развиваться по совершенно разным сценариям, вовлекать разнообразные клетки и структуры. Например, среди злокачественных новообразований легкого насчитывают, по современным представлениям, более шести гистологических типов, для каждого из которых необходимы свои терапевтические подходы (рис. 2) [1]. Мелкоклеточный рак легкого отличается стремительным течением, ранним метастазированием и очень плохим прогнозом. Карциноидные опухоли, происходящие из клеток диффузной нейроэндокринной системы, имеют наилучший прогноз; это единственный тип карцином легкого, который, как ныне считается, никак не связан с курением. Саркома легких — агрессивная опухоль, развившаяся из клеток соединительнотканных структур легкого. Аденокарциномы состоят преимущественно из железистых клеток и имеют периферическую локализацию. Опухоли этого типа зачастую развиваются у некурящих людей. Они могут нести активирующие мутации в генах EGFR, ALK и ROS1, которые являются терапевтической мишенью для действия таргетных препаратов — ингибиторов тирозинкиназ.

Рис. 2. Гистологические типы рака легкого: мелкоклеточный рак (14%); плоскоклеточный (эпидермоидный) рак (20%); аденокарцинома (38%); крупноклеточный рак (3%); карциноид (5%); мезенхимальные, в том числе саркомы и лимфомы (5%); опухоли смешанных типов — плоскоклеточный и аденокарцинома, аденокарцинома и мелкоклеточный и т.д. (15%)
Чтобы безошибочно установить гистологический тип опухоли в затруднительных ситуациях, вызванных, к примеру, маленьким размером образца или утратой опухолевыми клетками способности к образованию специфических структур (низкая степень дифференцировки), или выявить некоторые специфические характеристики новообразования, морфологи используют иммуногистохимическое окрашивание (ИГХ). Этот метод сформировался еще в середине 1980-х годов [2] и сразу стал одним из наиболее востребованных в клинической онкологии (рис. 3). Появление такого диагностического теста, например, существенно изменило роль патоморфологического исследования в лечении рака молочной железы: именно от результатов ИГХ-анализа на рецепторы к эстрогенам (ER) и прогестерону (PgR), которые синтезируется опухолевыми клетками при этом заболевании, зависит назначение эндокринной терапии. В настоящее время антагонисты эстрогенов, замедляющих деление клеток рака молочной железы, принимают примерно 70% пациенток [3]. С помощью ИГХ можно также обнаружить увеличение синтеза онкобелка HER2/neu (от англ. human epidermal growth factor receptor — рецептор эпидермального фактора роста, или трансмембранная рецепторная тирозинкиназа). Опухоли, вырабатывающие HER2/neu, оказались чувствительными к терапевтическим ингибиторам этой тирозинкиназы, и назначение соответствующих лекарственных препаратов (например, трастузумаба) основано на результатах тестов, в числе которых и ИГХ-анализ [4].

Рис. 4. Низкодифференцированная аденокарцинома легкого (а, среди фиброзной ткани отдельно расположенные опухолевые клетки) и положительная ИГХ-реакция с антителом к TTF-1 в ядрах опухолевых клеток (б)
В клиническом исследовании изучали эффективность EGFR-ингибитора (гефитиниба) на самом первом этапе лечения пациентов с мутацией EGFR [6]. Чтобы включить в исследование 25 больных, нам потребовалось проанализировать образцы тканей более 500 пациентов с раком легкого, что связано с низкой частотой этой мутации, которая в общей выборке больных не превышает 6–7%. Результаты исследования поражают воображение: эффект от препарата наблюдался у всех без исключения пациентов, в то время как аналогичный показатель при назначении стандартной терапии обычно не составляет 20–30% (рис. 5).
Рис. 5. Снижение размеров опухолевых очагов (%) в ответ на применение EGFR-ингибитора (гефитиниба) у пациентов с активирующими мутациями в гене EGFR: делецией 19-го экзона (19del) и заменой в 21-м экзоне (L858R) [6]
В настоящее время патоморфология переживает фундаментальные изменения. В стройную систему знаний, накопленных десятилетиями в рамках классической цитологии, гистологии и патологической анатомии, интегрируются новейшие представления о молекулярной патологии раковых клеток. Все это дает основания говорить о появлении новой дисциплины — молекулярной патологии [7]. Многие современные алгоритмы принятия врачебных решений уже ориентируются не столько на гистологические разновидности рака, сколько на молекулярные характеристики клеток. Однако роль патолога по-прежнему остается ведущей, поскольку именно он интегрирует все полученные сведения (микроскопические и молекулярные) в общий «портрет» опухоли.
Важность молекулярной морфологии в онкологии будет возрастать в ближайшем будущем, поскольку молекулярная диагностика больше не представляет собой однократное исследование, выполняемое только на этапе постановки диагноза. Многие современные технологии лечения рака предусматривают мониторинг характеристик опухолевых клонов на протяжении всех этапов онкологической медицинской помощи. В этом десятилетии большую популярность приобрели методы «жидкой биопсии», основанные на идентификации фрагментов опухолевых клеток в периферической крови. Другой важный аспект развития морфологии — ее интеграция с различными методами компьютерного анализа, искусственного интеллекта. На наших глазах морфология опухолей превращается из относительно консервативного раздела онкологии в одну из самых динамично развивающихся дисциплин современной медицины.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 16-04-00921).
Литература
1. Wistuba I., Brambilla E., Noguchi M. Chapter 17: Classic Anatomic Pathology and Lung Cancer // IASLC Thoracic Oncology. Pass H. I., Ball D., Scagliotti G. V. (eds) Aurora, Colorado, 2014; 217–240.
2. Taylor C. R., Burns J. The demonstration of plasma cells and other immunoglobulin-containing cells in formalin-fixed, paraffin-embedded tissues using peroxidase-labelled antibody // J. Clin. Pathol. 1974; 27(1): 14–20.
3. Pertschuk L. P., Tobin E. H., Gaetjens E. et al. Histochemical assay of estrogen and progesterone receptors in breast cancer: correlation with biochemical assays and patients’ response to endocrine therapies // Cancer. 1980; 46(12 Suppl): 2896–2901.
4. Pegram M. D., Lipton A., Hayes D. F. et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment // J. Clin. Oncol. 1998; 16: 2659–2671.
5. Stenhouse G., Fyfe N., King G. et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma // J. Clin. Pathol. 2004; 57(4): 383–387. DOI: 10.1136/jcp.2003.007138.
6. Moiseyenko V. M., Procenko S. A., Levchenko E. V. et al. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma // Onkologie. 2010; 33(5): 231–238. DOI: 10.1159/000302729.
7. Birner P., Prager G., Streubel B. Molecular pathology of cancer: how to communicate with disease // ESMO Open. 2016; 1(5): e000085. DOI: 10.1136/esmoopen-2016-000085.
Что значит экспрессия клеток опухоли
Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Таким образом, к настоящему времени накоплен определенный опыт исследования ОСК при различных солидных опухолях, однако вопросы, связанные с особенностями фенотипической организации и «поведении» данной популяции клеток при ряде заболеваний, в частности при различных формах рака желудка, остаются изучены не полностью.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
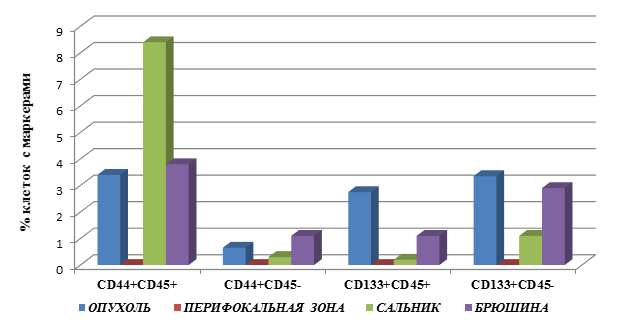
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
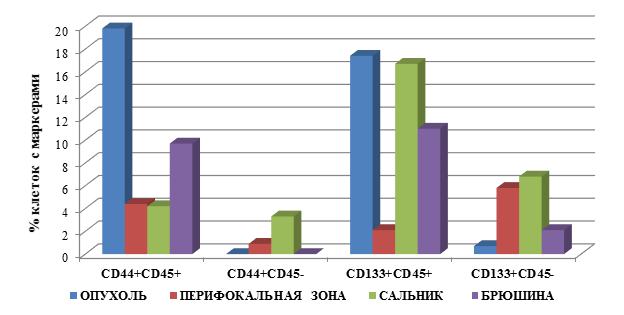
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.