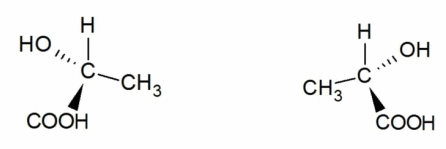что значит геометрические изомеры
Изомерия в органической химии
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
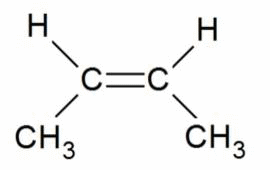
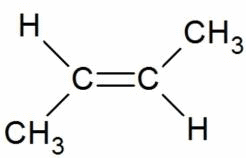
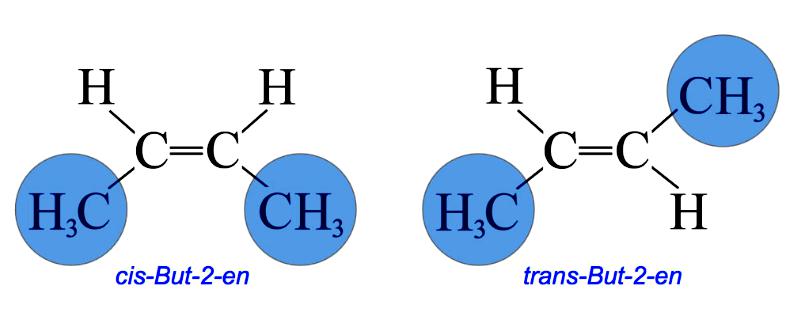
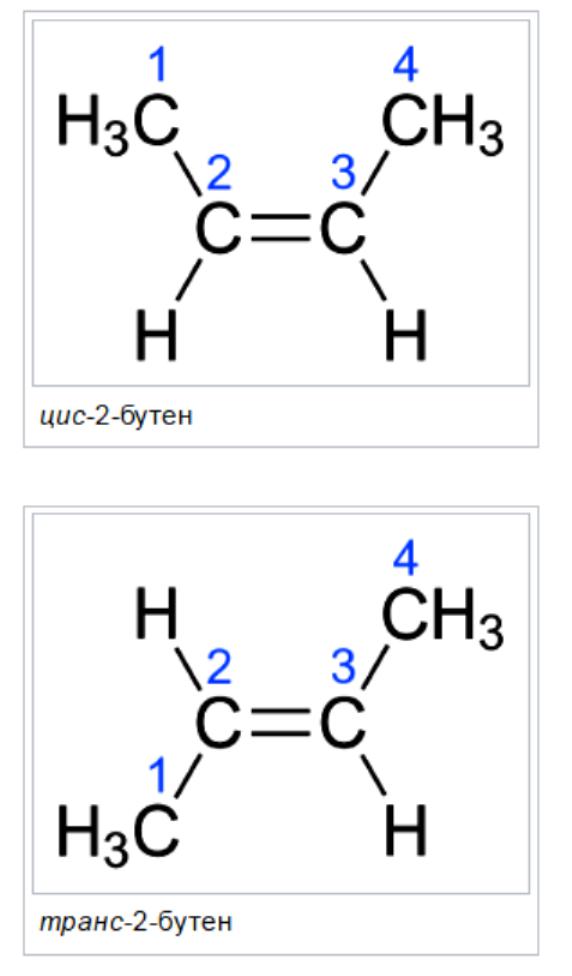
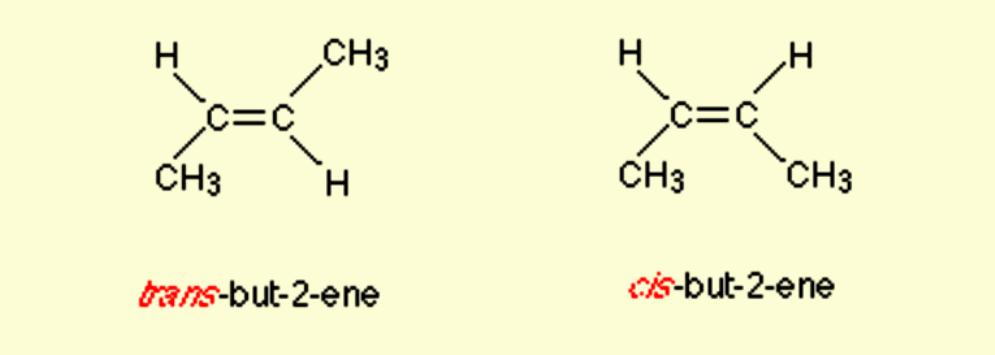
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Что значит геометрические изомеры
До появления теории химического строения А. М. Бутлерова оставалось неизвестным существование веществ, которые имеют один и тот же состав и одну и ту же молекулярную массу, но различающиеся расположением атомов. Эти вещества обладали разными свойствами. Способность атомов углерода к образованию четырёх ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава. Такое явление было названо изомерией.
Для пентана существует три изомера:
Температуры кипения бутана и пентана отличаются между собой, что служит доказательством того, что свойства соединений находятся в зависимости от строения их молекул.
это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение (различные структурные формулы), а, следовательно, обладают различными свойствами.
В органической химии существует несколько типов изомерии. Самым простым является структурная изомерия.
называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединений атомов).
В этом случае изомеры отличаются друг от друга только порядком связи между атомами в молекуле. Структурная изомерия имеет несколько разновидностей.
Изомерия углеродного скелета зависит от порядка соединения между собой атомов углерода в цепи (см. изомеры бутана и пентана).
Для правильного составления изомеров углеродного скелета необходимо соблюдать некоторые правила:
1. Записать углеродный скелет согласно числу атомов углерода.
2. Отрывают крайние атомы углерода (`»C»_1` или `»C»_5`) и располагают их у оставшихся в цепи атомов углерода, добиваясь максимально возможного числа перестановок. В результате чего первоначально записанный углеродный скелет укорачивается и принимает разветвлённое строение:
Следует иметь в виду, что произвольное укорачивание углеродной цепи исходного углеводорода не приводит к появлению нового изомера, а зачастую представляют собой одно и то же соединения.
3. Соблюдая условие четырёхвалентности атомов углерода, необходимо заполнить оставшиеся валентности атомами водорода
(*н – означает углеводород нормального (неразветвленного) строения).
Другой разновидностью структурной изомерии является
Например, положения кратной связи:
| `»CH»_2=»CH»-«CH»_2-«CH»=»CH»_2` | `»CH»_2=»CH»-«CH»=»CH»-«CH»_3` |
| пентадиен-1,4 | пентадиен-1,3 |
Или изомерия положения функциональной группы:
Если гидроксильных групп две, то число изомеров может также определяться взаимным расположением этих групп:
| `»HOCH»_2-«CH»_2-«CH»_2″OH»` | `»HOCH»_2-«CH»(«OH»)-«CH»_3` |
| пропандиол-1,3 | пропандиол-1,2 |
Ещё одним видом изомерия является
| `»CH»_3-«CH»_2-«OH»` | `»CH»_3-«O»-«CH»_3` |
Другим примером межклассовой изомерии являются карбоновые кислоты и сложные эфиры, например:
| `»CH»_3-«CH»_2″COOH»` | `»CH»_3-«COOCH»_3` | `»HCOOC»_2″H»_5` |
| Пропановая кислота | Метилацетат | Этилформиат |
Виды пространственной изомерии
называют соединения, имеющий одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счёт разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
Энантиомеры имеют одинаковые температуры плавления и кипения, растворимость, показатель преломления и другие характеристики. Их отличия проявляются только при изучении вращения веществом плоскости поляризации света или при взаимодействии с другим хиральным соединением. Способность вращать плоскость поляризации света называется оптической активностью. Смесь равных количеств энантиомеров называется рацематом.
Что такое геометрический изомер?
Краткая история изомерии
В своей книге по истории химии Томас Томсон в 1830 году писал, что:
Берцелиус применил теорию атома также к растительному царству, проанализировав несколько растительных кислот, и показывая свою атомную конституцию, но здесь возникает трудность, которую в нынешнем состоянии наших знаний, мы не можем преодолеть. Есть две кислоты, которые состоят из точно таких же атомов. Теперь, как мы должны учитывать эту поразительную разницу в свойствах? Несомненно, различными способами, в которых атомы расположенных в каждом из них.
Затем Томсон использовал различные схемы атомных символов, используемых в то время, чтобы объяснить, почему две кислоты с одним и тем же элементарным составом, относящихся к геометрическим изомерам имеют разные физические и химические свойства.
До начала XIX века считалось, что эти химические вещества, обнаруженные в живых организмах, обладают особой жизненной силой, связанной с живыми существами, и что они нужны в живых системах для воспроизводства. В 1828 году Велер синтезировал образец мочевины, (NH2) 2CO (также CH4N2O), которая была неотличимой от мочевины, выделенной из биологической мочи.
Он подготовил это «животное» вещество из явно неорганического (минералогического) исходного вещества цианата аммония, (NH4)NCO (также CH4N2O), что является результатом объединения хлорида аммония и цианата серебра. Таким образом барьер между «живой» и «неживой» изомерией рухнул.
Обозначение изомеров
В цис-изомере две подобные группы остаются на одной стороне двойной связи, а в транс-изомере они остаются в противоположной стороне. Например, 2-бутен имеет два изомера цис и транс.
В цис-изомере две метильные группы и две водородные группы остаются в одной и той же стороне двойной связи, тогда как в транс-изомере они остаются в противоположной стороне.
Когда одна, или больше групп, связанных с двойной связью, не являются одинаковыми, изомеры называются E или Z. Для уведомления об этом типе пользователю потребуется указать формулы углеводородов, имеющих геометрические изомеры, и определяют атом с наивысшим приоритетом (самый высокий атомный номер), прикрепленный к каждой двойной связи C. Если два атома с наивысшим приоритетом остаются на той же стороне изомера, который обозначен как Z, и, если они находятся в противоположной стороне, обозначаются как E.
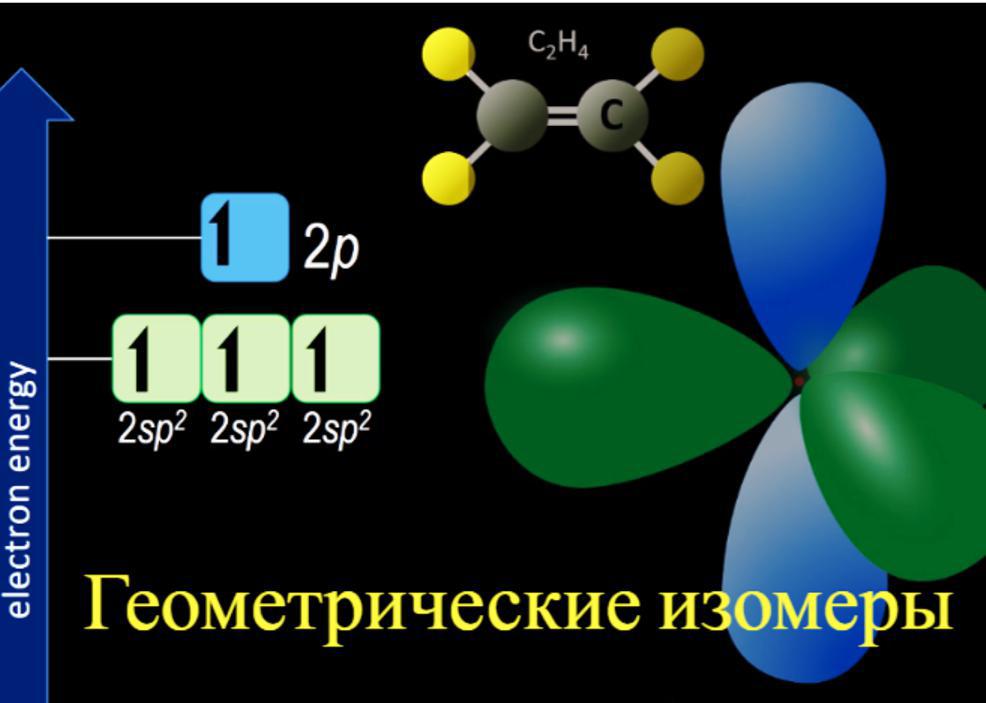
Углерод-углеродная двойная связь
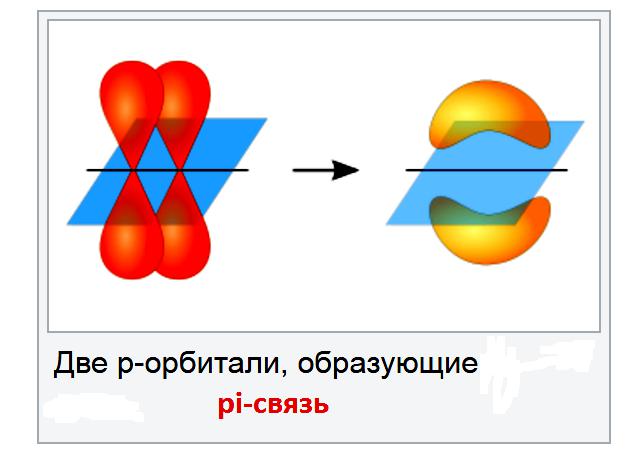
Общим примером ограниченного вращения является углерод-углеродная двойная связь. Эти связи включают связь pi, в большинстве условий их разрывать не выгодно.
Геометрические изомеры имеют структуру, которая влияет на физические свойства соединения.
Система Cis/Trans
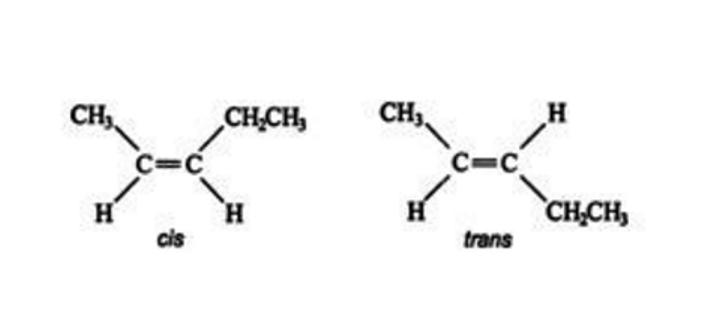
Именование Cis/Trans является самой простой системой соединений. Сначала идентифицируется самая длинная углеродная цепь в молекуле, а затем идентифицируются функциональные группы, представляющие интерес. В цис- изомере две рассматриваемые группы находятся на одной стороне двойной связи (cis означает «на той же стороне» на латыни). В транс- изомере две рассматриваемые группы находятся на противоположных сторонах двойной связи (транс означает поперек латинского языка). Например, два разных геометрических изомера бутена-2.
Оба атома с двойной связью имеют те же две группы, что и эти две группы, но они на одном из двойных углеродов отличаются друг от друга. Задача усложняется по мере того, как боковые цепи и функциональные группы становятся более сложными.
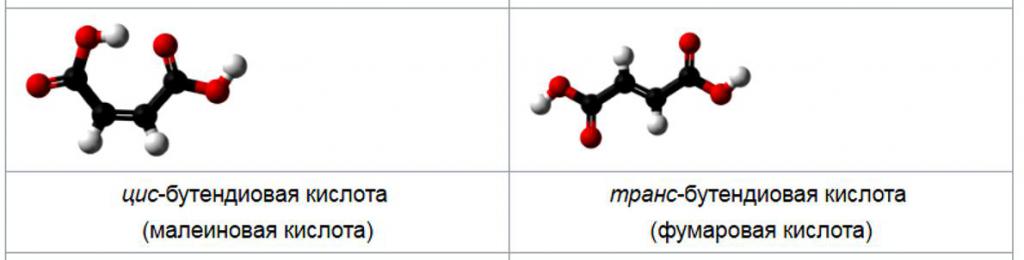
В официальной системе именования IUPAC используется обозначение E/Z. Специфической связи между цис/транс и E/Z нет, и эти две системы не являются взаимозаменяемыми. Обозначение E/Z использует правила приоритета Cahn-Ingold-Prelog, и считаются более надежными. Название IUPAC для фумаровой кислоты представляет собой транс-изомер с формулой HO2CCH=CHCO2H, а малеиновая кислота представляет собой цис-бутендиовую кислоту.
Циклические соединения
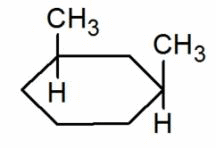
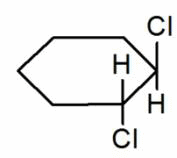
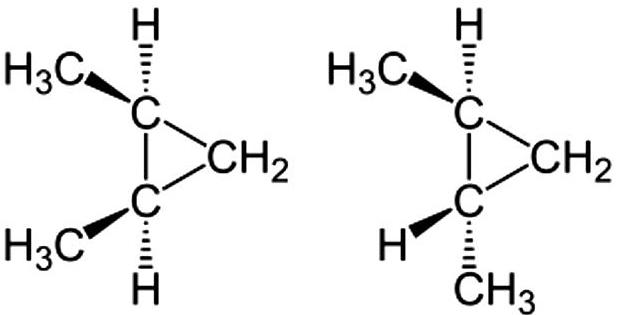
В циклическом соединении вращение между углеродной одинарной связью ограничено. Таким образом, для этого типа соединений также возможна изомерия, если к каждому углероду присоединяются две разные группы. Существует два изомера 1,2-диметилциклопропана.
Один из них представляет собой цис-изомер, где две метильные группы находятся на одной стороне, а другая представляет собой транс-изомер, где две метильные группы находятся на другой стороне.
Геометрические изомеры различаются по своим физическим свойствам. Это связано с формой изомеров и общим дипольным моментом. Например, они отличаются точкой кипения. Точка кипения цис- и транс-изомеров 1,2-дихлорэтилена составляет 60,3 °C и 47,5 °C, соответственно.
В цис-изомере присутствие двух дипольных связей (C-Cl) дает общий молекулярный диполь. Это приводит к межмолекулярным диполь-дипольным силам. Для этой силы цис-изомер имеет большую температуру кипения, чем транс-изомер, где две дипольные связи (C-Cl) отменены из-за их положения в противоположном направлении.
Причина, по которой невозможно вращать углерод-углеродную двойную связь, состоит в том, что есть две связи, соединяющие атомы углерода вместе и придется разорвать связь pi. Связи pi образуются при боковом перекрытии между p-орбиталями. Если попытается повернуть углерод-углеродную двойную связь, p-орбитали больше не будут выстраиваться в линию, и поэтому связь pi будет нарушена. На это затрачивается энергии, и это происходит только в том случае, если соединение сильно нагревается.
Построение структурных формул
Очень легко пропустить важные элементы геометрических изомеров во время построения структурных формул при сокращении. Например, очень заманчиво рисовать but-2-ene.Если пользователь напишет это неправильно, то соединение уже не будет изомером. Если есть хоть малейший намек на то, что может быть использован изомер, всегда необходимо использовать соединения, содержащие углерод-углеродные двойные связи, показывающие правильные углы (120°) вокруг атомов углерода на концах связи. Другими словами, необходимо использовать формат, показанный на рисунке.
Соединения, содержащие углерод-углеродную двойную связь, имеют ограниченное вращение. Чтобы получить изомеры, должны быть выполнены обязательные условия:
Не имеет значения, совпадают ли левые группы с правыми или нет.
Алкены: молекулярные и структурные формулы
Структурная формула для этена представлена на рисунке выше. В более длинных алкеновых цепях дополнительные атомы углерода присоединены друг к другу с помощью одних ковалентных связей. Каждый атом углерода также присоединен к достаточным атомам водорода для получения в общей сложности четырех одиночных ковалентных связей.
В цепях с четырьмя и более атомами С, двойная связь может быть расположена в разных положениях, что приводит к образованию структурных изомеров. В дополнение к структурным изомерам алкены также образуют стереоизомеры. Поскольку вращение вокруг множественной связи ограничено, группы, присоединенные к атомам с двойной связью, всегда остаются в одинаковых относительных положениях.
Эти «заблокированные» позиции позволяют химикам идентифицировать различные изомеры из заместителей для того, чтобы определить, какое вещество имеет геометрические изомеры. Например, один структурный изомер C5H10 имеет следующие стереоизомеры.
Изомер слева, в котором два заместителя (метильная и этильная группы) находятся на одной стороне двойной связи, называют цис-изомер, тогда как изомер справа с двумя неводородными заместителями на противоположных сторонах является транс-изомером.
Например, хлор имеет приоритет, потому что он тяжелее. С правой стороны бром превосходит углерод. В-третьих, определяются положения двух атомов более высокого ранга. Если два атома находятся в цис-положении, расположение Z (с немецкого zusammen, что означает «вместе»). Если атомы, или группы, находятся в транс-положении, расположение E (от немецкого entgegen, что означает «противоположность»).
Соединения с жесткой двойной связью
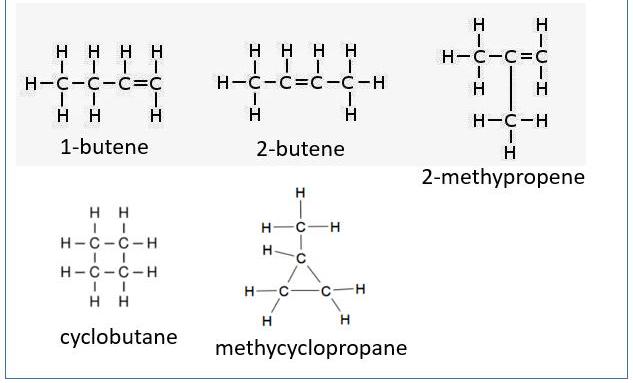
Геометрические изомеры бутен представляет собой алкен с жесткой двойной связью. Это означает, что на самом деле существует четыре изомера, а не три, в позиции двойной связи. Существует пятый и шестой углеводород того же состава, но они не являются алкенами, несмотря на ту же формулу.
Кольцевое образование циклобутана или метилциклопропана занимает пространство двух атомов водорода, как двойная связь, что приводит к тому, что они имеют формулы, идентичные различным бутенам.
Геометрические изомеры примеры:
Изомеры бутена
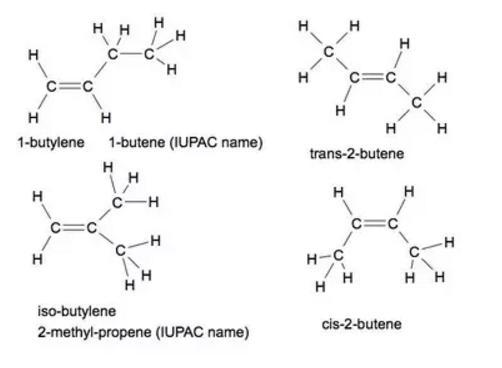
Бутен имеет множество применений, от топлива в автомобиле до продуктовых сумок, которые носят ежедневно сотни миллионов жителей планеты. Химическая формула для бутена: C4H8, что означает, что она состоит из четырех атомов С и восьми атомов Н, соединение относится к алкену.
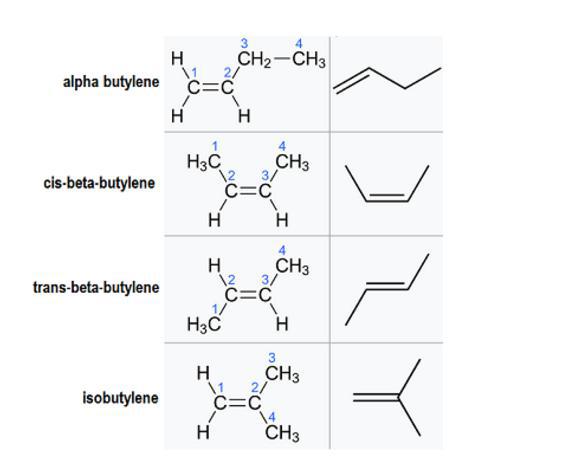
Существует несколько различных изомеров или молекулярных структур, которые могут образовывать это соединение (в скобках указаны названия IUPAC):
Хотя все они имеют одну и ту же формулу, их структуры различаются. Соотношения между каждым из этих геометрических изомеров в основном конституциональны, что означает, что они имеют одну и ту же молекулярную формулу, но разные связи. Исключением является цис-бета-бутилен и транс-бета-бутилен.
Многие знают, что транс-жиры вредны для человека, а ненасыщенные жиры полезные для него. Единственная разница между этими двумя жирами заключается в том, что у одного есть транс-связь, а у другого есть цис-связь, тем не менее эта небольшая дифференциация может существенно повлиять на функцию молекулы.
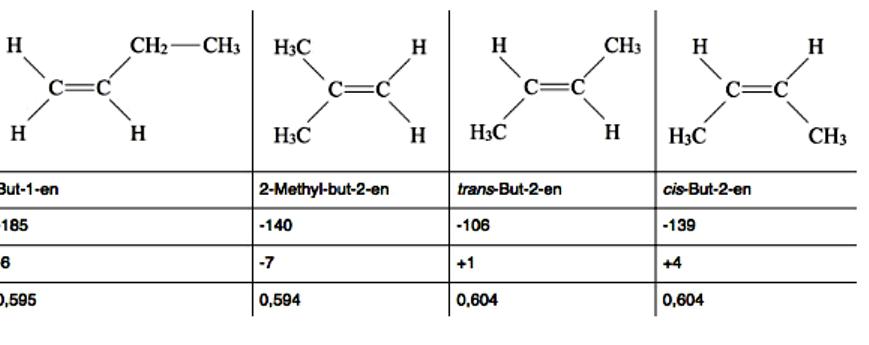
Несмотря на то что каждый из этих изомеров бутена состоит из одних и тех же материалов, каждый из них имеет разные физические свойства. Например, точка кипения:
Материал для производства пластмасс
Бутены представляют собой алкены с четырьмя атомами углерода, C4H8. Существует несколько различных структурных или конфигурационных изомеров бутена, в том числе геометрические и оптические изомеры. Все четыре бутена имеют схожие физические свойства, будучи бесцветными газами, тяжелыми в воде, хорошо растворимы в эфире и алканах. Различия в физических свойствах объясняются структурой молекул. Например, cis-But-2-en имеет более высокую температуру кипения, чем trans-But-2-en, потому что он является более сильным диполем.
Две алкильные группы цис-изомера работают со своим + I эффектом в одном направлении и тем самым усиливают, в то время как две алкильные группы транс-изомеров действуют в противоположных направлениях и, таким образом, ослабляют друг друга. Формулы углеводородов имеющих геометрические изомеры, указывают по стандартам IUPAC. But-1-en имеет такую низкую точку плавления, так как CC одинарная связь между вторым и третьим атомом углерода свободное вращения и этильная группа может, вращаться вокруг оси поворота во всех направлениях.
But-1-en и But-2-ene, используются для получения бутадиена и бутан- 2-ol. Кроме того, алкены используются в качестве алкилирующих агентов. Таким образом, из изобутена и изобутана получают важный топливный 2,2,4-Trimethyl-pentan, более известный как изооктан. Наконец, бутены являются исходными материалами для производства некоторых пластмасс, поскольку их легко полимеризовать. Известный пластик на But-1-en основе, является полибутеном-1, из которого производятся трубы.
Пентан, n-пентан, изопентан
Геометрическая изомерия
Смотреть что такое «Геометрическая изомерия» в других словарях:
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ — то же, что цис транс изомерия … Большой Энциклопедический словарь
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ — ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ, см. ИЗОМЕРЫ … Научно-технический энциклопедический словарь
геометрическая изомерия — то же, что цис транс изомерия. * * * ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ, то же, что цис транс изомерия (см. ЦИС ТРАНС ИЗОМЕРИЯ) … Энциклопедический словарь
геометрическая изомерия — geometrinė izomerija statusas T sritis chemija apibrėžtis Izomerija, kurią lemia pakaitų, esančių prie skirtingų atomų, padėties nevienodumas dvigubojo ryšio arba žiedo plokštumos atžvilgiu. atitikmenys: angl. geometric isomerism rus.… … Chemijos terminų aiškinamasis žodynas
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ — цис трансизомерия, см. в ст. Изомерия … Большой энциклопедический политехнический словарь
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ — то же, что цис траис изомерия … Естествознание. Энциклопедический словарь
Геометрическая изомерия — см. Стереоизомерия … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Изомерия — Не следует путать с изомерией атомных ядер. Изомерия (от др. греч. ἴσος «равный», и μέρος «доля, часть») явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но… … Википедия
Изомерия — (от Изо. и греч. méros доля, часть) химических соединений, явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие… … Большая советская энциклопедия
ИЗОМЕРИЯ — (от изо. игреч. meros доля, часть) явление в химии, гл. обр. органической, к рое заключается в существовании соединений, одинаковых по составу и мол. массе, но различающихся по строению (структурная И.) или по расположению атомов в пространстве … Большой энциклопедический политехнический словарь