что значит клинические испытания вакцины
Российские вакцины не прошли все фазы клинического исследования?
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н «Об утверждении правил надлежащей клинической практики» (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
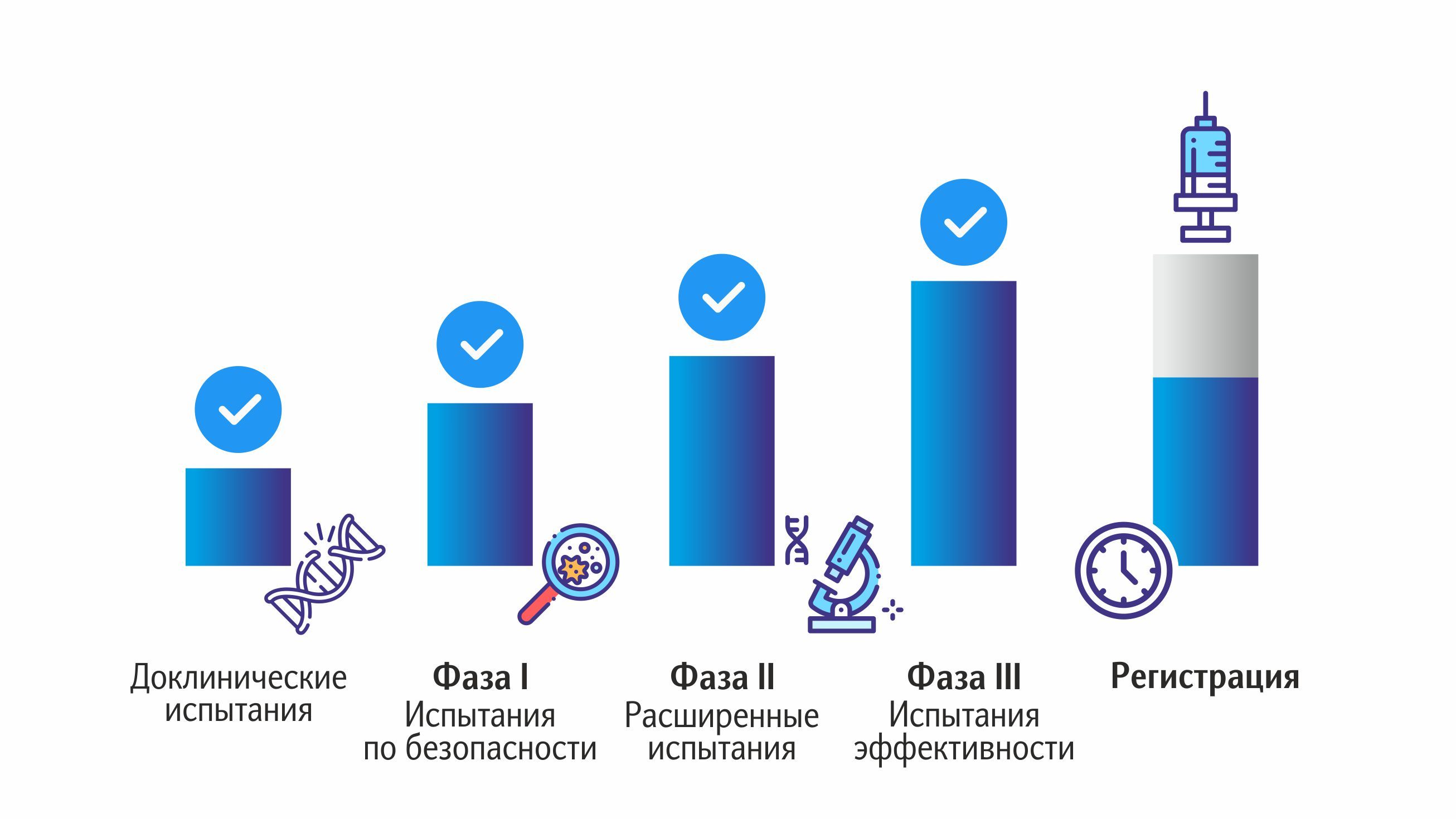
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
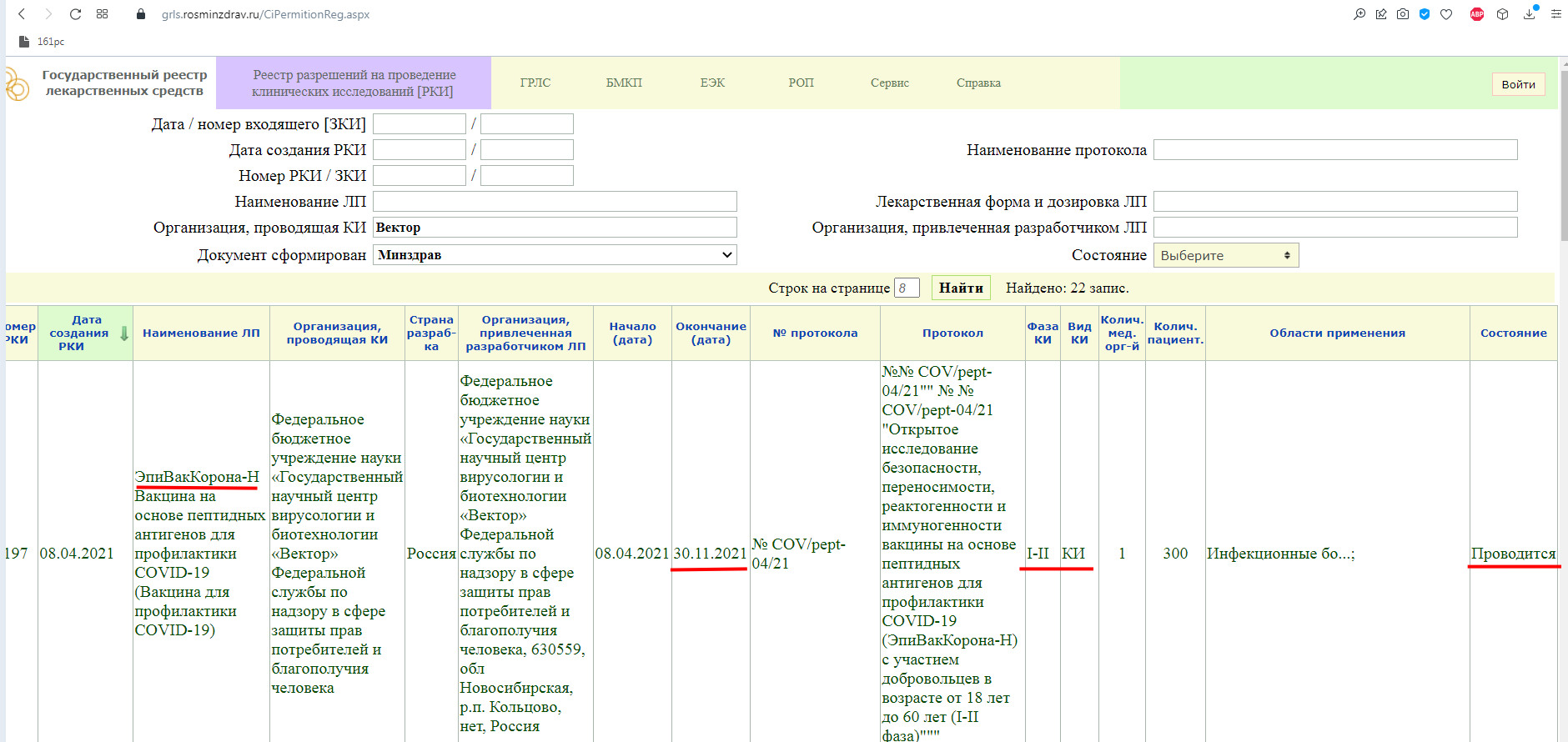
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
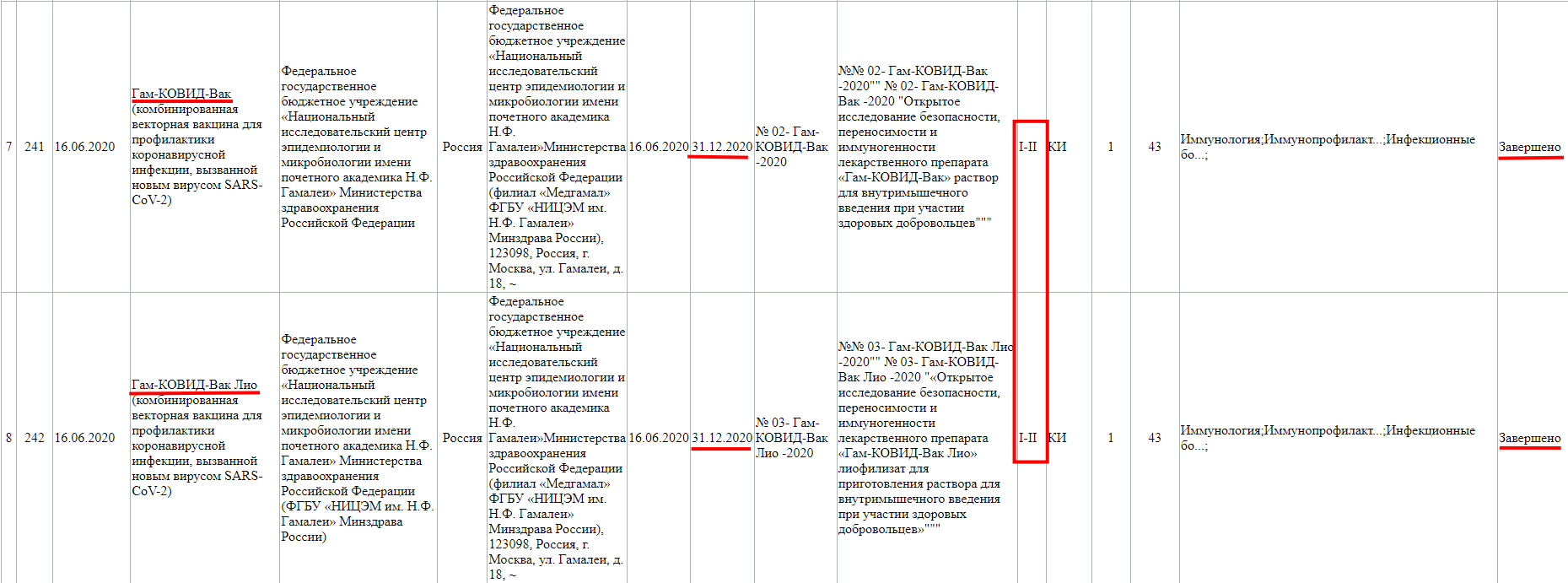
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.
Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.
Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года.
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
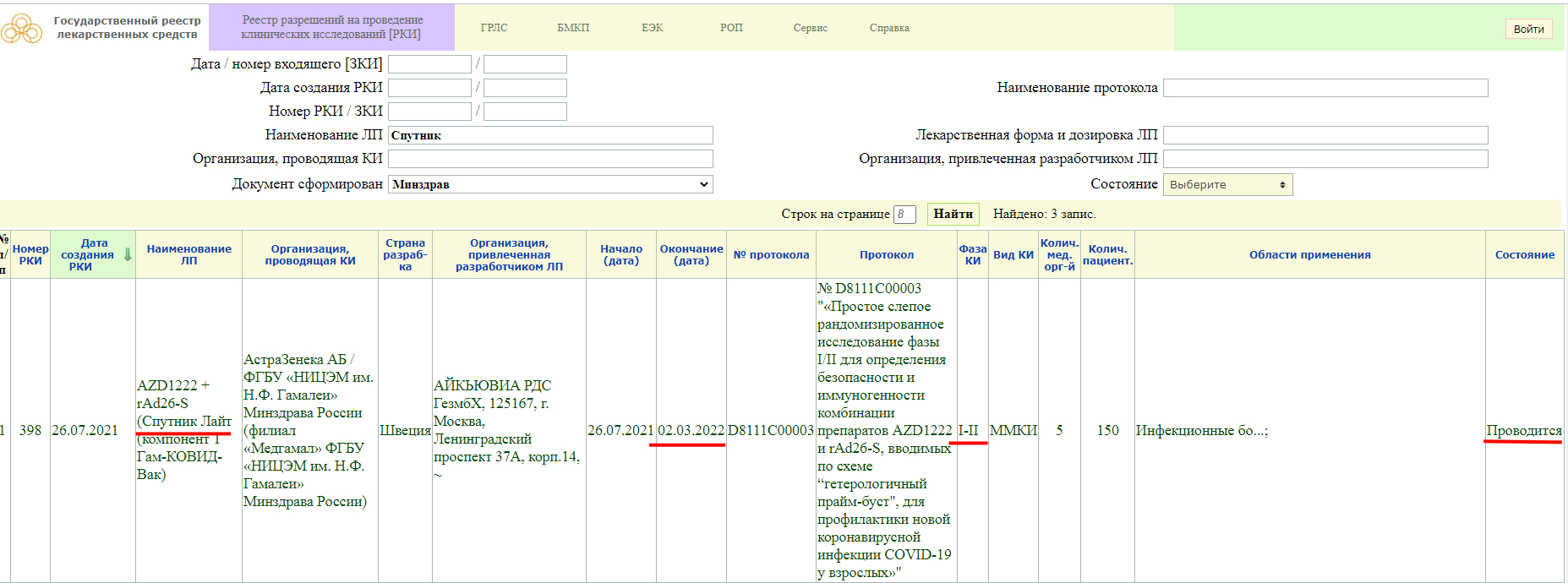
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.
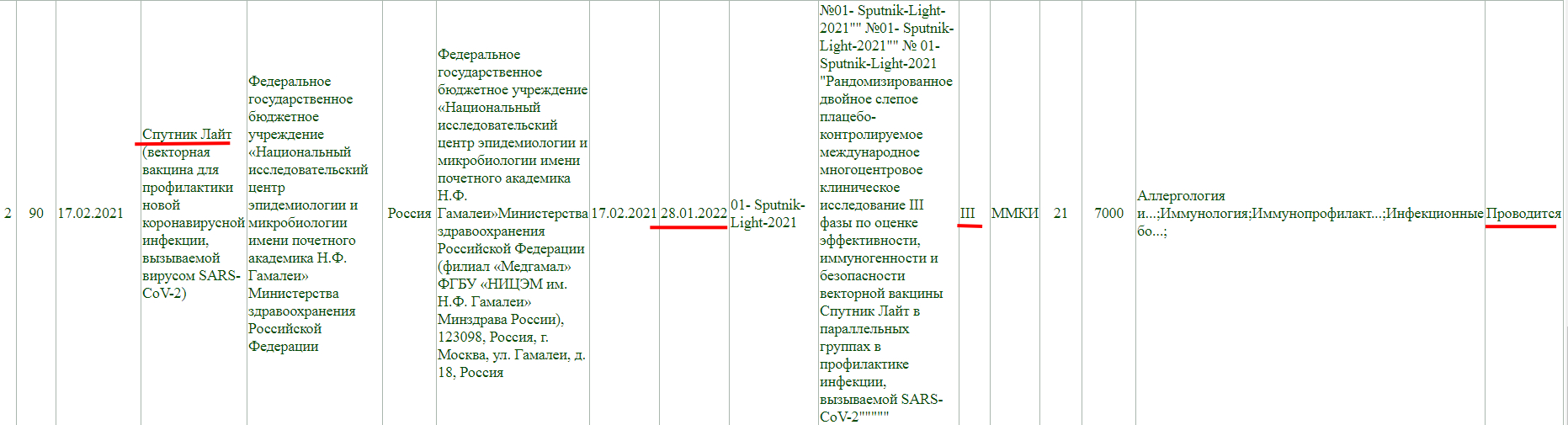
Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
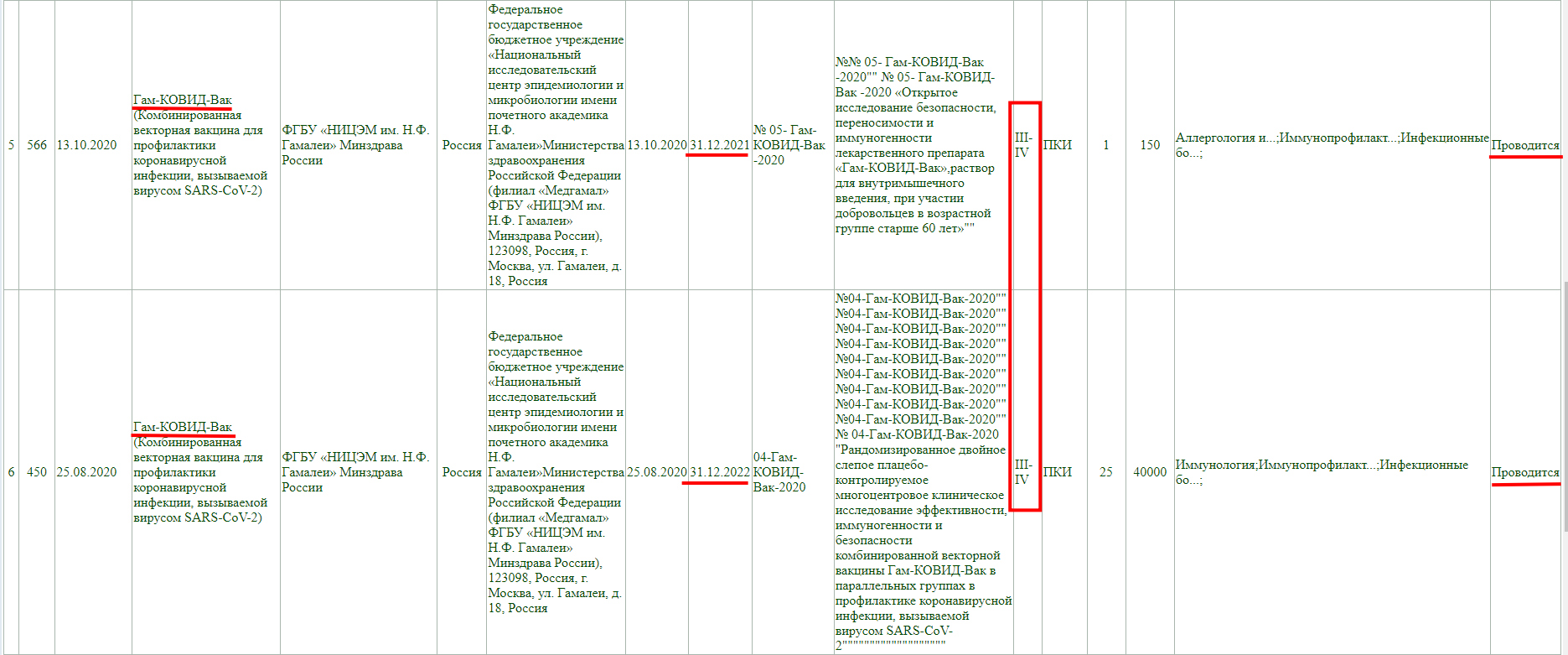
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Страх отравляет лучше любого яда, он убивает предателей долго и мучительно
Мурашко заявил, что в России проводятся доклинические исследования еще двух вакцин против COVID-19
Минздрав обеспокоен высоким уровнем смертности среди пенсионеров
Глава Крыма Аксёнов: «Сам получу сертификат фармацевта, надоело враньё»
Более 60% российских туроператоров могут стать банкротами
Украина и Молдавия блокируют поставку «Спутника V» в Приднестровье
Си Цзиньпин заявил, что Китай и Тайвань должны объединиться
Шойгу сообщил об успешном испытании противоспутниковой системы
Хабаровчане передали в прокуратуру 10 тысяч подписей против введения QR-кодов
В американской лаборатории случайно обнаружили несколько пробирок с ярлыками «оспа»
Если население мира не будет прививаться, появятся новые виды более опасных штаммов вируса
В Казани задержаны четверо подозреваемых в торговле поддельным алкоголем после массового отравления студентов
Станьте членом КЛАНА и каждый вторник вы будете получать свежий номер «Аргументы Недели», со скидкой более чем 70%, вместе с эксклюзивными материалами, не вошедшими в полосы газеты. Получите премиум доступ к библиотеке интереснейших и популярных книг, а также архиву более чем 700 вышедших номеров БЕСПЛАТНО. В дополнение у вас появится возможность целый год пользоваться бесплатными юридическими консультациями наших экспертов.
Вакцинация как медицинский эксперимент. Правовые гарантии неучастия
Авторы: Дмитрий Казаков, Виталина Степанова, Кристина Табакина
В связи с проведением массовой вакцинации от COVID-19 актуальным представляется вопрос об условиях клинических испытаний лекарственных препаратов и их особенностях для отдельных категорий, участвующих в испытаниях граждан.
Вакцина, безусловно, является лекарственным препаратом в соответствии с определением, закрепленным в пункте 1 статьи 4 Федеральный закон № 61-ФЗ « Об обращении лекарственных средств», поскольку является веществом, вступающим в контакт с организмом человека или животного, проникает в органы, ткани организма и применяется для профилактики заболевания.
На данный момент ни одна из отечественных вакцин не прошла все фазы клинических испытаний ( см.: Реестр разрешений на проведение клинических исследований Государственного реестра лекарственных средств).
Под клиническим испытанием лекарственного препарата понимается изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и ( или) пищевыми продуктами. [1]
Главное отличие клинического испытания от доклинического исследования заключается в том, что испытуемыми являются не животные, а люди.
Согласно статье 39 Федерального закона « Об обращении лекарственных препаратов» для проведения клинических испытаний необходимо получить разрешение уполномоченного органа. Во-первых, необходимо предоставить документы, содержащие всю имеющуюся информацию о препарате по итогам его лабораторного и доклинического исследования, а также план проведения испытания. Во-вторых, на основании документально подтвержденных сведений Советом по этике при проводится этическая экспертиза и выдается заключение об этической обоснованности возможности или невозможности проведения клинического исследования лекарственного препарата. [2] И только на основании такого заключения Министерство здравоохранения РФ выдает разрешение на проведения клинических испытаний.
В соответствии со статьей 43 ФЗ «Об обращении лекарственных препаратов» участие пациентов является добровольным и информированным.
Для этих целей на подпись гражданину представляется информационный листок, где должны быть указаны следующие сведения:
Кратко в данном разделе должна быть представлена информация, относящаяся к безопасности, фармакодинамике, эффективности и дозозависимости эффектов исследуемого продукта. Должны быть освещены значимые различия в характере/частоте нежелательных реакций, как для различных показаний, так и для различных популяций. Должны быть описаны возможные риски и нежелательные реакции, которые можно ожидать, основываясь на накопленном опыте применения, как исследуемого продукта, так и сходных с ним продуктов. Должны быть также описаны меры предосторожности или специальные методы наблюдения, которые необходимо применять при использовании продукта с исследовательскими целями; [3]
об условиях участия граждан в клиническом исследовании лекарственного препарата для медицинского применения;
Подробный перечень информации, предъявляемый потенциальному исследуемому для обозрения, обозначен в разделе 7 «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика», он именуется брошюрой исследователя и содержит сводное изложение результатов клинического и доклинического изучения исследуемого продукта, значимых для его исследования на человеке.
На наш взгляд, кроме перечисленных выше сведений потенциальному участнику клинических испытаний должен быть представлен под роспись перечень противопоказаний для применения данного лекарственного средства с детальной расшифровкой каждого из них.
Следует отметить, что перед началом испытаний в обязательном порядке должно проводиться предварительное обследование состояния здоровья, в том числе должен быть детально и всесторонне оценен иммунный статус участника эксперимента. В противном случае невозможно будет назвать эту процедуру исследованием, поскольку не представится возможным оценить динамику показателей здоровья, в частности невозможно будет установить иммунный ответ испытуемого.
Необходимым условием является право на односторонний отказ от участия в испытании на любой его стадии без каких-либо ограничений со стороны пациента. Данная норма отражает положения Хельсинской декларации, а также конституционное право граждан, закрепленное в статье 21 — никто не может быть без добровольного согласия подвергнут медицинским, научным или иным опытам.
Субъектов испытаний в зависимости от наличия ограничений можно разделить на 3 группы.
Первую группу составляют категории граждан, которым на законодательном уровне установлен императивный запрет на участии в клинических испытаниях. В эту группу входят:
1.1. Дети сироты и дети без попечения;
1.2. Военнослужащие по призыву;
1.3. Сотрудники правоохранительных органов;
1.4. Лица, отбывающие наказания в местах лишения свободы и лица, находящиеся под стражей в следственных изоляторах.
В данный перечень, по нашему мнению, необходимо также включить пациентов, находящихся на стационарном лечении, состояние здоровья которых исходя из медицинских показателей не позволяет пациентам с онкологическими, инфекционными, аллергологическими, пульмонологическими и другими заболеваниями быть участниками клинический испытаний лекарственных препаратов.
Вторую группу составляют лица, которые могут стать субъектами клинических испытаний только при соблюдении определенных условий:
2.1. Несовершеннолетние могут участвовать в испытании только при условии, что: родители или законные представители дали на это информированное письменное согласие, проведение испытания необходимо для укрепления здоровья детей или профилактики инфекционных заболеваний в детском возрасте либо если целью такого исследования является получение данных о наилучшей дозировке лекарственного препарата для лечения детей. Такому исследованию должно предшествовать клиническое исследование лекарственного препарата для медицинского применения на совершеннолетних гражданах ( за исключением случаев, если исследуемый лекарственный препарат предназначен исключительно для использования несовершеннолетними).
2.2. Женщины в период беременности и грудного вскармливания при условии, что препарат предназначен для применения женщинами в указанный период, либо если исключается риск вреда женщине, плоду и ребенку.
2.3. Военнослужащие, при условии, что лекарственный препарат специально разработан для применения в условиях военных действий, чрезвычайных ситуаций, профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов
2.4. Лица с психическими заболеваниями могут стать субъектами клинических испытаний при наличии письменного согласия их законных представителей и при условии, что препарат предназначен для лечения психических заболеваний.
В третью группу входят граждане, не перечисленные в первых двух группах. Между тем, можно выделить отдельную подгруппу наиболее « уязвимых» граждан, такое понятие вводится пунктом 3.44 «ГОСТ Р ИСО 14 155−2014. Национальный стандарт Российской Федерации. Клинические исследования. Надлежащая клиническая практика». Прямых запретов на их участие в испытаниях нет, однако, исходя из морально-этических соображений и международного опыта, не рекомендуется привлекать в качестве испытуемых:
В частности предполагается, что на готовность указанных лиц участвовать в клиническом исследовании может излишне влиять ожидание, обоснованное или нет, или выгода, связанная с участием или негативной реакцией администрации в случае отказа от участия.
[1] п. 42 ст. 4 Федерального закона № 61-ФЗ « Об обращении лекарственных средств»
[2] Приказ Минздрава России № 986н «Об утверждении Положения о Совете по этике»
[3] «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика».
Вакцины: путь от изобретения до применения
Производство вакцин – многоступенчатый, длительный процесс, который требует участия тысяч человек и серьезных материальных вложений. Его стандарт был разработан в середине XX века. На сегодняшний день в мире зарегистрировано около 100 вакцин, и ученые накопили достаточно опыта, чтобы быстро отреагировать и разработать новый препарат в случае критической ситуации.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
В разработке принимают участие ученые разных направлений – вирусологи, биологи, иммунологи, бактериологи и другие. И на первом этапе им необходимо не только выявить возбудителя и «опознать» его, но и тщательно изучить особенности жизнедеятельности, генетического материала, антигенов. Более того, перед исследователями стоит задача понять, как организм отвечает на проникновение микроба, какие иммунные механизмы задействованы.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
in vitro – это технология выполнения опытов «в пробирке», т.е. вне живого организма.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
НА ЗАМЕТКУ! Возникает вопрос: почему бы тогда не создать одну вакцину, например, от гриппа, и делать прививку каждый год, не вспоминая об этом заболевании? Дело в том, что вирус гриппа постоянно мутирует, свойства антигенов изменяются, и ученым приходится ежегодно создавать новые препараты. Но это не значит, что новую вакцину делают «наугад». ВОЗ располагает сетью специализированных центров, в которых происходит сбор данных о вспышках гриппа по всему миру. Ученые непрерывно анализируют штаммы, выявляют новые разновидности, проводят антигенные исследования. То есть, состав будущего препарата обоснован конкретными фактами. Более подробно о вакцине от гриппа можно почитать в нашей статье: « Вековая война с гриппом: про вакцины от начала до наших дней». К слову, другая ситуация с ВИЧ. Мутации этого вируса происходят в несколько раз чаще, чем гриппа. «Уловить» изменения на данный момент исследователи не могут, поэтому вакцины от него нет.
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
ЭТО ИНТЕРЕСНО! Своеобразные «прививки» от оспы делали в Китае в 15 веке. У больного человека брали струпья, растирали в порошок и давали вдыхать здоровому. Среди других вариантов «вакцинации» – надетое на здорового человека белье инфицированного или вкладывание в ноздри ватного тампона, пропитанного гнойным содержимым язв. Какими бы варварскими не казались нам эти методы сейчас, в то время они реально помогали!
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Дальнейшая «жизнь» вакцины
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
НА ЗАМЕТКУ! Стоит коснуться и такого вопроса, как материальные затраты. Разработка вакцины требует огромных вложений. Это и заработная плата сотрудникам, и содержание лабораторий и центров, содержание животных, реагенты и многое-многое другое. Кроме того, значительная доля от продаж уже зарегистрированного препарата уходит на постклинический мониторинг – сбор, фиксацию и анализ данных.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
Кроме этого, существуют и другие способы производства вакцин, инновационные и дорогостоящие, например, полное воссоздание вируса искусственным путем. Иммунитет реагирует на него, как на «живого», но вероятность заражения нулевая, так как в такой частице отсутствует геном.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
В ряде ситуаций допускается экстренный выпуск препаратов. Однако это не означает, что они «не проверены». В любом случае вакцина проходит установленные протоколом этапы, но в очень сокращенном варианте. В качестве примера можно взять COVID-19 или вирус Эбола.
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.