что значит коричневая рвота
Тошнота и рвота: инфекция или «неврология»?
Откуда «берется» рвота
Итак, в головном мозге есть, как минимум, 2 зоны, раздражение которых провоцирует рвотный рефлекс.
Одна из них, основная – рвотный центр, реагирует только на поступающие сюда нервные импульсы. А последние могут исходить от органов желудочно-кишечного тракта, глотки, брюшины (оболочки внутренних органов, отделяющей их друг от друга), вестибулярного аппарата, таламуса, гипоталамуса и коры головного мозга.
Помимо прочего, рвотный центр провоцирует рвоту при механическом давлении на него извне. А причиной такого «явления» может быть опухоль, повышенное внутричерепное давление, отек и другие патологии головного мозга.
Рецепторы второй «рвотной» зоны раздражаются только под действием химических веществ, как лекарства, токсины, яды, некоторые метаболиты обмена веществ (как например, кетоны при декомпенсации сахарного диабета) и прочие. Однако, импульс от этой зоны, в любом случае сначала поступает в рвотный центр, и лишь отсюда реализуется механизм рвотного рефлекса.
Рвотный центр «посылает» соответствующую команду мышцам диафрагмы, грудной и брюшной стенок, а также желудка, что (не вдаваясь в «детали») провоцирует спастические сокращения последних.
А «эволюционной целью» рвоты является избавление организма от опасного раздражителя, которым чаще всего служит инфекция, химические вещества или избыток собственных пищеварительных ферментов.
«Неврология» или инфекция
Как уже, вероятно, очевидно, причин возникновения рвоты может достаточно много. Однако, «умение» вовремя отличить рвоту центрального генеза (со стороны головного мозга) от других ее вариантов имеет важное прогностическое значение.
В частности, рвота неврологического происхождения:
Помимо прочего, такая рвота нередко связана с головной болью и/или головокружением, а также другими признаками поражения головного мозга. А по мере прогрессирования процесса, очевидно, возникает все чаще и чаще.
Причиной такой рвоты может быть:
Поэтому появление таких симптомов требует обязательного КТ или МРТ головного мозга и консультации невролога.
«Инфекционная» рвота всегда имеет связь с приемом пищи, сопровождается тошнотой и часто нарушениями стула.
Такая рвота часто бывает многократной, может сопровождаться температурой и выраженным обезвоживанием (сильная слабость, бледность, сухость кожи и слизистых, сердцебиение), а также возникать у нескольких членов семьи почти одномоментно.
А среди самых частых возбудителей:
При этом, в зависимости от возбудителя, значимо отличается не только характер лечения, но и риск возможных осложнений. Поэтому, при возникновении таких симптомов следует сдать кал на ПЦР-выявление возбудителей острых кишечных инфекций.
Что такое кровотечение желудочно-кишечное? Причины возникновения, диагностику и методы лечения разберем в статье доктора Нижегородцева А. С., хирурга со стажем в 16 лет.
Определение болезни. Причины заболевания
Желудочно-кишечное кровотечение — это жизнеугрожающее состояние, при котором кровь истекает в просвет пищевода, желудка или кишечника. Его основная опасность заключается в том, что на ранних стадиях или при небольших объёмах кровопотери пациент может вовсе не испытывать никаких симптомов. Это связано с отсутствием болевых рецепторов на слизистой оболочке органов пищеварительного тракта. Так как основное предназначение этих органов — перерабатывать поступающую еду, кровь проходит через пищеварительный тракт так же, как и жидкая пища.
При повторных или продолжающихся кровотечениях, а также при нарастании объёма кровопотери у человека появляются видимые характерные симптомы : рвота кровью или кровянистые выделения из заднего прохода. Так как при этом кровь покидает кровеносное русло, в организме быстро или постепенно нарушаются обменные процессы, больной слабеет, его кожа становится бледной, вырабатывается липкий холодный пот, нарушается сознание. В итоге пациент попадает в больницу (чаще в карете скорой помощи), но шансы на излечение в таком шоковом для организма состоянии на фоне массивной кровопотери порой стремительно «тают» даже в условиях специализированного стационара, не говоря уже о случаях, когда своевременно оказать квалифицированную медпомощь просто невозможно.
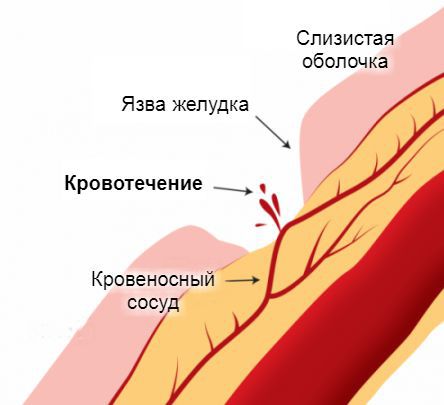
Источник желудочно-кишечного кровотечения — эрозированные кровеносные сосуды, прилегающие к стенкам пищевода, желудка или кишечника. Эрозия сосудов связана с появлением дефектов на поверхности слизистой оболочки этих органов. Чаще всего они бывают бессимптомными и возникают под действием болезнетворных агентов. Постепенно эти дефекты достигают глубоких слоёв, «разъедая» стенки пролегающих к ним кровеносных сосудов. Примерно по такому же принципу в стенки сосудов прорастают раковые опухоли на поздних стадиях развития. Достигая определённых размеров, они начинают разрушаться сами, нарушая при этом целостность сосудистой стенки.
Симптомы желудочно-кишечного кровотечения
Являясь осложнением других болезней, желудочно-кишечное кровотечение может возникнуть на фоне жалоб, свойственных этим заболеваниям. Например, при кровотечении на фоне язвенного колита или язвы желудка пациента будут беспокоить боли в животе. Но в случае неинтенсивного кровотечения или непродолжительных подкравливаний какие-либо проявления могут отсутствовать. Такое возможно при бессимптомном течении язвы или рака желудка и двенадцатиперстной кишки. Порой кровотечение становится первым признаком уже развившейся болезни.
Заподозрить это грозное состояние на начальных стадиях может только опытный внимательный доктор, но для этого к нему нужно своевременно обратиться. Поэтому при болях в животе и ухудшении общего самочувствия рекомендуется не заниматься самолечением, а показаться врачу.
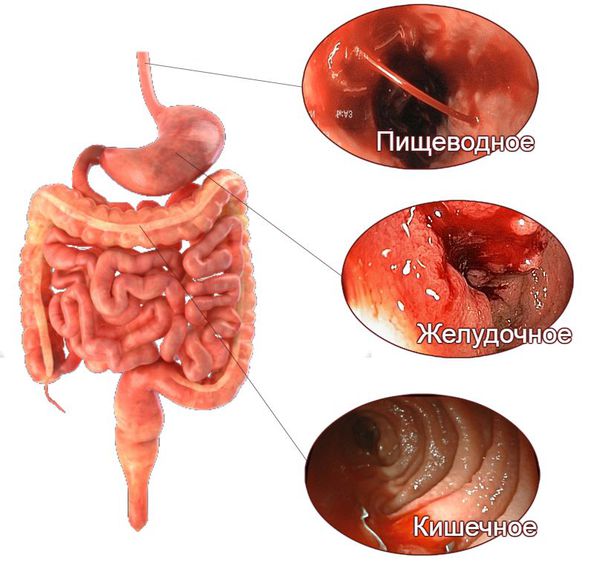
Признаки желудочно-кишечного кровотечения группируют в зависимости от того, из какого отдела они происходят — верхнего или нижнего.
При кровотечениях из верхнего отдела (пищевода, желудка и двенадцатиперстной кишки) на первое место выходят следующие симптомы:
Поражению нижних отделов желудочно-кишечного тракта, помимо того же чёрного стула и мелены, в большей степени свойственны следующие симптомы:
Кроме указанных симптомов при кровотечении наблюдаются общие признаки, связанные с кровопотерей. Кровь в кровеносном русле становится более густой, хуже переносит питательные вещества и кислород, что вызывает:
Патогенез желудочно-кишечного кровотечения
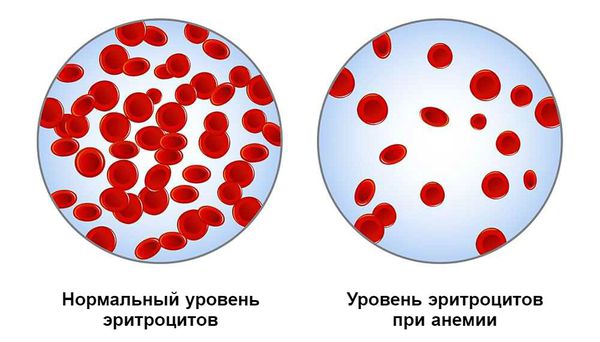
На 4-5 день после кровотечения костный мозг начинает активно восполнять недостающее количество потерянных элементов крови, в частности эритроциты и тромбоциты. Если кровотечение больше не возникало, уровень эритроцитов нормализуется через 2-3 недели.
На самочувствие пациента и клиническую картину желудочно-кишечного кровотечения влияют объём и скорость кровопотери. От них зависит, насколько полноценно и быстро механизмы компенсации и приспособления организма восстановят объём циркулирующей крови.
В случае самостоятельной остановки кровотечения и потери не больше 10 % от исходного объёма крови состояние организма, как правило, легко стабилизируется за счёт вышеописанных процессов.
Классификация и стадии развития желудочно-кишечного кровотечения
Классифицируется желудочно-кишечное кровотечение по различным признакам.
По локализации выделяют:
По клиническому течению различают:
По объёму оно может быть:
По характеру выделяют:
По этиологии (причине возникновения) оно может быть язвенным и неязвенным, по частоте — первичным и рецидивным (повторным).
При кровопотере лёгкой степени тяжести больной может не обратить внимания на возможную лёгкую тошноту, сухость во рту, слабость и познабливание, пока у него не появится рвота кровью. Также при лёгком кровотечении может возникнуть чёрный дегтеобразный стул.
Осложнения желудочно-кишечного кровотечения
Желудочно-кишечное кровотечение может привести к следующим последствиям:
Постгеморрагическая анемия — это состояние организма после кровотечения, при котором снижается уровень гемоглобина в крови.
Медленно развивающаяся анемия формируется на фоне хронического или рецидивирующего небольшого кровотечения. Её проявления менее выражены, так как организм частично успевает компенсировать состояние.
В случае массивной и быстрой кровопотери возникновение анемии сопровождается развитием геморрагического шока с высокой вероятностью летального исхода.
Геморрагический шок — это смертельно опасное состояние, вызванное быстрым снижением объёма циркулирующей крови больше чем на 15-20 %. При такой кровопотере резко нарушается снабжение тканей кислородом и энергетическими продуктами, сбивается адекватный тканевой обмен и нарастает интоксикация.
Несмотря на мощные компенсаторные возможности организма и современные медицинские технологии, смертность от геморрагического шока остаётся актуальной проблемой. Даже среди тех пациентов, которым удаётся пережить состояние геморрагического шока, уровень смертности достаточно высокий.
Геморрагический шок переносится по-разному: кто-то жалуется только на усталость, а кто-то поступает в медучреждение на машине скорой помощи без сознания. Всё зависит от состояния организма и возраста пациента. Очень молодые и очень пожилые люди более склонны к ранней декомпенсации после большой потери крови.
Общие признаки геморрагического шока:
Осложнением геморрагического шока является полиорганная недостаточность, которая может стать причиной смерти. Она развивается в 30-70 % случаев.
Острая почечная недостаточность, возникшая на фоне острого нарушения кровоснабжения, приводит к глубоким нарушениям выделительной функции почек. Её развитие проходит четыре фазы:
Диагностика желудочно-кишечного кровотечения
Обследование пациента с подозрением на желудочно-кишечное кровотечение проводится хирургом. Он тщательно выясняет историю заболевания, оценивает характер рвотных масс и испражнений, очень осторожно ощупывает живот, чтобы не усилить кровотечение. Для определения следов крови и возможной причины кровопотери выполняет пальцевое исследование прямой кишки.
Чтобы приблизительно оценить объём кровопотери при первом обращении больного к врачу, доктор измеряет частоту сердечных сокращений и артериальное давление, оценивает окрас кожного покрова:
Для оценки тяжести процесса кровь анализируется на предмет количества эритроцитов, гемоглобина и тромбоцитов, определяется её свёртывающая способность, уровень креатинина, мочевины и печёночных ферментов. Также важно провести исследование кала на скрытую кровь. Положительный результат будет сохраняться в течение двух недель после одного кровотечения, а чёрный дёгтеобразный стул — в течение пяти суток.
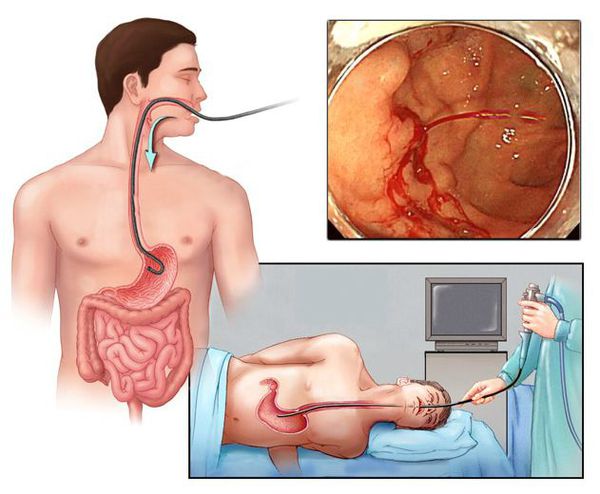
Наиболее ценным и точным методом диагностики при подозрении на желудочно-кишечное кровотечение является эндоскопия. С её помощью врач может не только обнаружить источник кровопотери, но и остановить кровотечение, тем самым избавив больного от сложных и опасных хирургических операций и в значительной мере улучшив прогноз на выздоровление.
Лечение желудочно-кишечного кровотечения
Пациента с подозрением на желудочно-кишечное кровотечение необходимо экстренно госпитализировать в хирургическое отделение. Там ему окажут квалифицированную помощь:
Особенно активным должно быть лечение в случае острого кровотечения, сопровождающегося кровавой рвотой и меленой. Его следует проводить до полной стабилизации клинических, эндоскопических и гематологических показателей.
Существует два направления в терапии желудочно-кишечных кровотечений: консервативное и хирургическое. Выбор направления и метода лечения зависит от локализации кровотечения, его интенсивности и причины возникновения.
Консервативная тактика возможна в двух случаях:
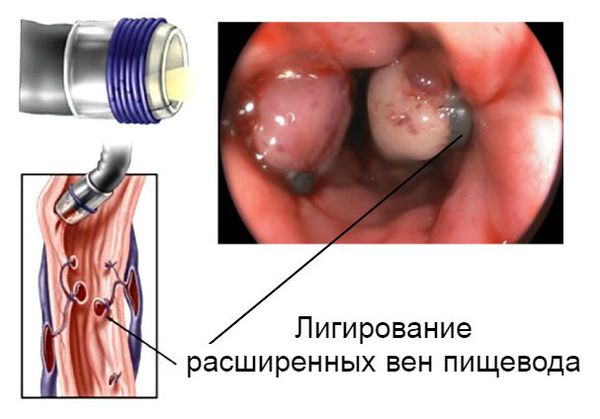
Кровотечение, которое возникло на фоне варикозно расширенных вен пищевода, можно остановить эндоскопически, т. е. не прибегая к открытой операции. Для этого выполняется лигирование (перевязка) или склерозирование (склеивание) изменённых сосудов. Метод склерозирования сегодня используется редко. В некоторых случаях кровотечения из желудка или кишечника можно остановить с помощью электрокоагуляции (прижигания током) или обкалывания кровоточащих сосудов.
Большинство кровотечений, связанных с язвенной болезнью, внезапно и самостоятельно прекращаются. При этом в 20 % случаев оно со временем возобновляется, в связи с чем больному может потребоваться оперативное лечение.
Хирургическая тактика требуется тогда, когда консервативные методы лечения оказались малоэффективными или вовсе не улучшили состояние больного. Заключается она в остановке кровотечения путём выполнения различных операций:
Прогноз. Профилактика
Основой профилактики такого грозного осложнения, как желудочно-кишечное кровотечение, является своевременное лечение причинных заболеваний. Для этого Всемирная организация здравоохранения разработала определённые рекомендации:
1. Чтобы своевременно диагностировать заболевания в верхних отделах пищеварительного тракта, рекомендуется, начиная с 40-50 лет, каждый год обращаться к терапевту или гастроэнтерологу для профилактического осмотра. Также один раз в два года нужно делать гастроскопию (ЭГДС) с определением кислотности желудочного сока, выполнением биопсии для анализа на H. Pylori и гистологическим исследованием подозрительных участков. Эти мероприятия позволят вовремя выявить гастрит, дуоденит и инфекцию H. Pylori, избежать развития язвенной болезни и онкологии.
2. Для своевременной диагностики заболеваний в нижних отделах пищеварительного тракта рекомендуется, помимо вышеуказанных процедур, 1 раз в пять лет выполнять колоноскопию с уточняющей биопсией подозрительных участков, начиная с 45 лет. Это позволит вовремя пролечить заболевания кишечника и избежать развития желудочно-кишечного кровотечения.
Рвота: причины и виды
Рвота: причины и виды
Рвота представляет собой вынужденное неконтролируемое изгнание содержимого желудка или кишечника через рот при участии мышц брюшного пресса и диафрагмы. Рвота также сопровождается слабостью, слюнотечением, слезотечением и головокружением. Как чувство тошноты, так и рвота запускаются особым нервным центром, располагающимся в стволе головного мозга. В центр «тошноты и рвоты» сигналы приходят от чувствительных рецепторов пищеварительного тракта, поэтому раздражение этих рецепторов запускает рвотный рефлекс. Раздражение чувствительных рецепторов рвотного рефлекса происходит например, при сильном растяжении стенок желудка, при употреблении в пищу продуктов с раздражающим действием, при, воспалении стенок желудка и кишечника (гастрит, гастроэнтерит).
Непосредственное раздражение «рвотного центра» также может вызвать рвоту, даже если при этом отсутствует всякое раздражение со стороны пищеварительного тракта. Этот феномен наблюдается при различных заболеваниях нервной системы.
Причины возникновения тошноты и рвоты
Тошнота и рвота на фоне сильного поноса (возможно с примесью крови) значительного повышения, температуры сильной слабости могут быть признаком кишечной инфекции. Сильная тошнота и рвота, сопровождаемые обесцвечиванием кала, потемнением мочи и желтухой – это явный признак вирусного гепатита. При подозрении на гепатит или острую кишечную инфекцию нужно срочно показать больного врачу.
Тошнота и рвота, возникающие периодически (часто) в сопровождении таких симптомов, как боли в животе, боли в желудке кислая отрыжка, горечь во рту, обесцвечивание кала хронический понос, запоры, обычно являются симптомом гастрита, язвенной болезни желудка и двенадцатиперстной кишки, холецистита, хронического гепатита, хронического панкреатита. В данных случаях лечение тошноты и рвоты возможно только после устранения основной болезни.
Так как запуск и сам процесс рвоты управляются «рвотным центром» головного мозга, некоторые болезни нервной системы могут вызывать рвоту и тошноту. 
Повышенное внутричерепное давление характеризуется стойким повышением давления спинномозговой жидкости и сдавлением головного мозга. Медленное повышение внутричерепного давления наблюдается, например, при опухолях мозга. В подобных случаях тошнота и рвота возникают либо по утрам, либо легкое подташнивание наблюдается в течение всего дня. Одновременно с тошнотой больной может жаловаться на головную боль, расстройство равновесия, ухудшение зрения, нарушения походки или чувствительности, слабость в какой-либо части тела.
Резкое повышение внутричерепного давления (отек мозга, черепно-мозговая травма, сотрясение, ушиб) сопровождаются сильной рвотой, нарушением сознания.
Внимание! Стойкие головные боли, сопровождаемые подташниванием или периодической «беспричинной» рвотой, могут быть признаком опухолей головного мозга или прочих болезней, характеризующихся медленным повышением внутричерепного давления! При обнаружении этого симптома нужно немедленно обратиться к врачу.
Инфекционные заболевания нервной системы (менингит, бореллиоз), поражения нервной системы при сифилисе или СПИДе также сопровождаются рвотой. Из описанных состояний чаще всего наблюдается менингит. Тошнота и рвота могут быть одними из первых симптомов менингита.
Внимание! Кроме тошноты и рвоты, при менингите наблюдается высокая температура, сильная головная боль, сильное напряжение затылочных мышц. При обнаружении этих признаков нужно немедленно вызвать врача! 
Поражения вестибулярного аппарата (вертиго, морская болезнь, укачивание) часто сопровождаются тошнотой и рвотой в сочетании с выраженным головокружением, потерей равновесия. При доброкачественном вертиго тошнота и головокружение возникают внезапно в тот момент, когда больной резко меняет положение тела и головы (например, поворачивается на другой бок в постели). При морской болезни или укачивании тошнота и рвота возникают во время путешествия на морском или сухопутном транспорте. При обнаружении таких симптомов следует обратиться к невропатологу, отоневрологу!
Мигрень – это особый вид головной боли, которая встречается у 15-20% населения. При мигрени тошнота и рвота возникают на фоне сильной (иногда пульсирующей) головной боли. Кроме тошноты и рвоты, во время приступа мигрени наблюдается светобоязнь (больной не переносит яркого света), непереносимость шума. Приступы мигрени повторяются периодически и могут провоцироваться такими продуктами, как вино, шоколад, сыр, а также сильными запахами. При подозрении на мигрень следует обратиться к невропатологу!
Другие причины рвоты
Тошнота и рвота во время беременности
Рвота у детей

У новорожденных детей рвоту не стоит путать со срыгиванием. Здоровый ребенок в норме срыгивает 5-10 мл содержимого желудка несколько раз в день, срыгивание связано с приемом пищи и может служить признаком переедания, а также возникать в результате быстрого кормления и заглатывания воздуха. Однако, если срыгивания у ребенка возникают слишком часто и сопровождаются изгнанием большого количества содержимого желудка (рвота), малыш плохо набирает в весе – следует показать ребенка врачу, так как это может служить симптомом стеноза пищевода или привратника желудка. У детей более старшего возраста рвота может возникнуть в результате острого аппендицита или гастроэнтерита, в таком случае у ребенка возникает рвота и понос с повышением температуры и сильной болью в животе. Рвота, беспокойство, плач ребенка, отсутствие стула или желеобразный, малинового цвета стул может указывать на инвагинацию кишечника (кишечная непроходимость), что является неотложным состоянием. 
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 2. Начало статьи читайте в № 6, 2017 г.
Голодание
Голодание — это состояние организма, связанное с частичным или полным нарушением поступления пищи. В состоянии голодания резко снижаются источники энергии организма для важнейших структур организма. В условиях дефицита питательных веществ в организме образование энергии происходит за счет интенсификации глюкогенеза и синтеза кетоновых тел. Содержание глюкозы в крови уменьшается до нижних пределов нормы (3,5 ммоль/л) и на этом уровне поддерживается и в последующие периоды голодания. В печени при голодании глюкоза не в состоянии обеспечить должного количества оксалоацетата, поскольку ее просто нет в клетке. Поэтому при голодании жирные кислоты не «сгорают» в ЦТК, а превращаются в кетоновые тела.
Снижение запасов гликогена в печени сопровождается усиленным поступлением в нее свободных жирных кислот из адипоцитов. Концентрация жирных кислот в крови увеличивается в 3–4 раза по сравнению с постабсорбтивным состоянием. Уровень кетоновых тел в крови через неделю голодания повышается в 10–15 раз. В то же время дефицит углеводов тормозит окисление кетоновых тел, замедляя ресинтез их в высшие жирные кислоты [13].
Энергетические потребности мышц и большинства других органов удовлетворяются за счет жирных кислот и кетоновых тел. При низком уровне инсулина глюкоза в мышечные клетки не проникает, потребителями глюкозы являются инсулинонезависимые клетки и прежде всего клетки мозга, но и в этой ткани биоэнергетика частично обеспечивается кетоновыми телами. При такой концентрации ацетоуксусная кислота активно декарбоксилируется с образованием ацетона, который выводится с выдыхаемым воздухом и через кожу. Уже на 3–4 день изо рта и от кожи голодающего исходит запах ацетона.
Организм включает альтернативные способы выработки энергии — это глюконеогенез и синтез кетокислот, которые потребляются центральной нервной системой. При голодании повышается выброс глюкагона, который активирует липолиз в адипоцитах и окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль клетки, где опять превращается в оксалоацетат и используется в глюконеогенезе.
Глюконеогенез продолжается за счет распада тканевых белков. Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании. Пируват образуется в печени из лактата и аланина. Аланин и глутамин являются наиболее важными глюкогенными аминокислотами при голодании. Пируват и метаболиты ЦТК способны образовывать оксалоацетат и включаться в глюконеогенез.
При голодании подавляется использование ацетил-КоА в ЦТК, и он используется исключительно для синтеза оксиметилглутарил-КоА, что приводит к увеличению образования кетоновых тел. В этих условиях кетоновые тела являются альтернативным (глюкозе) энергетическим материалом для мозга и других тканей. 75% потребности мозга в энергии удовлетворяется за счет ацетил-КоА [4].
Если голодание продолжается дни, недели — включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании наблюдаются крайне низкие концентрации инсулина в крови. В этом случае интенсивный кетогенез представляет собой компенсаторно приспособительную реакцию.
Интенсивность обмена веществ в целом снижена: через неделю голодания потребление кислорода уменьшается примерно на 40%, происходят торможение окислительных процессов в митохондриях и угнетение окислительного фосфорилирования с образованием АТФ, т. е. развивается гипоэнергетическое состояние.
Накапливаясь в крови, кетоновые тела подавляют секрецию и активность глюкокортикоидов, тем самым препятствуя разрушению структурных белков организма и угнетая секрецию глюкагона [2]. Если в это время голодающему вводить аланин или другие гликогенные аминокислоты, уровень глюкозы в крови повышается, а концентрация кетоновых тел снижается.
При голодании кетоз опасности не представляет, так как не достигает степени кетоацидоза. Последний развивается при сопутствующих факторах — дегидратации, алкогольной интоксикации и других состояниях.
Алкогольная интоксикация
Гиперпродукция кетокислот и кетоацидоз после чрезмерного употребления спиртного частое наблюдаемое состояние. Катаболизм этилового спирта осуществляется главным образом в митохондриях печени. Здесь окисляется от 75% до 98% введенного в организм этанола. Окисление алкоголя — сложный биохимический процесс. Основную роль в метаболизме этанола играет никотинамидадениндинуклеотид (NAD). Этот фермент превращает этанол в токсический метаболит — ацетальдегид и восстановленный NADH, а последний соответствует синтезу ацетоацетата и β-оксибутирата.
Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD + в клетке. Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы. В ходе реакции образуются уксусная кислота.
Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации оксалоацетата в митохондриях гепатоцитов, может «сгорать» в ЦТК или использоваться на синтез жирных кислот или кетоновых тел.
На начальных стадиях алкоголизма ацетил-КоА в ЦТК — основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот.
В период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идет на синтез кетоновых тел. Увеличение концентрации NADH по сравнению с NAD + замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу. Повышение в крови содержания лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации [14].
Способствует усиленному кетогенезу при алкогольной интоксикации гипогликемические состояния, связанные с рвотой и голоданием. Известно также, что у таких пациентов уровень инсулина в крови снижен, тогда как содержание кортизола, гормона роста, глюкагона и адреналина повышено. Этанол тормозит глюконеогенез. Дегидратация в этих случаях способствует кетогенезу.
Кетоз при нарушении гормональной регуляции
На уровень глюкозы в крови влияет широкий спектр гормонов, при этом только инсулин вызывает гипогликемический эффект. Контринсулярным действием с повышением уровня глюкозы крови обладают все гормоны: глюкагон, адреналин, глюкокортикоиды, адренокортикотропный (АКТГ), соматотропный (СТГ), тиреотропный (ТТГ), тиреоидные.
Эффекты инсулина и контринсулярных гормонов в норме регулируют стабильный уровень глюкозы в крови. При низкой концентрации инсулина усиливаются гипергликемические эффекты других гормонов, таких как глюкагон, адреналин, глюкокортикоиды и гормон роста. Это происходит даже в том случае, если концентрация этих гормонов в крови не увеличивается.
Патогенез кетоза при избытке тироксина, глюкокортикоидов, соматотропина или/и других гормонов, в сущности, аналогичен уже рассмотренным механизмам гиперпродукции кетокислот вследствие избытка контринсулярных гормонов [6]. Известно, что в период усиленного роста, а также при гипертиреозе наступает значительное похудание.
Стресс
При стрессе активируется симпатическая нервная система и выброс контринсулярных гормонов, происходит истощение углеводных резервов организма, нарушается способность печени синтезировать и откладывать гликоген. Происходит избыточное поступление в печень неэтерифицированных жирных кислот. В результате повышенной продукции глюкокортикоидов идет распад белков и усиленное образование кетоновых тел из кетогенных аминокислот.
Гиперкортицизм
Ацетонемический синдром может быть первым клиническим проявлением гиперкортицизма, когда характерные признаки заболевания еще не сформировались.
Глюкокортикоиды способствуют усилению мобилизации нейтральных жиров из жировой ткани и тормозят липогенез. Но это действие в организме может перекрываться другими эффектами данных гормонов: способностью вызывать гипергликемию и стимулировать секрецию инсулина, накопление гликогена в печени, что приводит к торможению мобилизации жира и его отложению в жировой ткани; способностью в больших дозах задерживать жиромобилизующее и стимулирующее окисление жиров соматотропином.
Этим можно объяснить накопление жира в жировых депо при гиперкортицизме (болезни и синдроме Иценко–Кушинга). Кроме того, при этом состоянии увеличено образование дигидрокортизона, который стимулирует пентозный цикл и превращение углеводов в жиры. Кортикотропин, стимулируя секрецию глюкокортикоидов, может влиять на жировой обмен в том же направлении, но, помимо этого, обладает еще и экстраадреналовым жиромобилизующим действием [6].
Тиреотоксикоз
Избыток тиреоидных гормонов в крови может быть следствием заболеваний, проявляющихся гиперфункцией щитовидной железы. Тяжелым осложнением основного заболевания, сопровождающегося гиперфункцией щитовидной железы, является тиреотоксический криз, который представляет собой резкое обострение всех симптомов тиреотоксикоза. Чрезмерное поступление в кровь тироидных гормонов вызывает тяжелое токсическое поражение сердечно-сосудистой системы, печени, нервной системы и надпочечников. В клинической картине характерны резкое возбуждение (вплоть до психоза с бредом и галлюцинациями), которое затем сменяется адинамией, сонливостью, мышечной слабостью, апатией. Усиливаются диспепсические расстройства: жажда, тошнота, рвота, жидкий стул. Возможно увеличение печени. На этом фоне резко усиливаются процессы кетогенеза, что может спровоцировать симптомы ацетонемии.
Тироксин обладает жиромобилизующим эффектом. При гипертиреозе усилен обмен углеводов. Увеличена утилизация глюкозы тканями. Активируется фосфорилаза печени и мышц, следствием чего является усиление гликогенолиза и обеднение этих тканей гликогеном. Увеличивается активность гексокиназы и всасывание глюкозы в кишечнике, что может сопровождаться алиментарной гипергликемией. Активируется инсулиназа печени, что вместе с гипергликемией вызывает напряженное функционирование инсулярного аппарата и в случае его функциональной неполноценности может привести к развитию сахарного диабета. Усиление пентозного пути обмена углеводов способствует образованию НАДФ-Н2. В надпочечниках это вызывает повышение стероидогенеза и большее образование кортикостероидов [4].
Дефицит гормонов
Гипогликемия всегда встречается при пангипопитуитаризме — заболевании, характеризующемся снижением и выпадением функции передней доли гипофиза (секреции адренокортикотропина, пролактина, соматотропина, фоллитропина, лютропина, тиреотропина). В результате резко снижается функция периферических эндокринных желез. Однако гипогликемия встречается и при первичном поражении эндокринных органов (врожденная дисфункция коры надпочечников, болезнь Аддисона, гипотиреоз, гипофункция мозгового слоя надпочечников, дефиците глюкагона). При дефиците контринсулярных гормонов снижается скорость глюконеогенеза в печени (влияние на синтез ключевых ферментов), повышается утилизация глюкозы на периферии, снижается образование аминокислот в мышцах — субстрата для глюконеогенеза.
Дефицит глюкокортикоидов
Первичная надпочечниковая недостаточность является следствием уменьшения секреции гормонов коры надпочечников. Под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортицизма. Симптомы надпочечниковой недостаточности развиваются только после разрушения 90% объема ткани надпочечников.
Причины гипогликемии при надпочечниковой недостаточности схожи с причинами гипогликемии при гипопитуитаризме. Отличием является уровень возникновения блока — при гипопитуитаризме снижается секреция кортизола из-за дефицита АКТГ, а при надпочечниковой недостаточности из-за разрушения ткани самих надпочечников.
Гипогликемические состояния у больных с хронической надпочечниковой недостаточностью могут возникать как натощак, так и через 2–3 часа после приема пищи, богатой углеводами. Приступы сопровождаются слабостью, чувством голода, потливостью. Гипогликемия развивается в результате снижения секреции кортизола, уменьшения глюконеогенеза, запасов гликогена в печени.
Дефицит катехоламинов
Данное состояние может возникать при надпочечниковой недостаточности с поражением мозгового слоя надпочечников. Катехоламины, попадая в кровь, регулируют высвобождение и метаболизм инсулина, снижая его, а также увеличивают высвобождение глюкагона. При снижении секреции катехоламинов наблюдаются гипогликемические состояния, вызванные избыточной продукцией инсулина и пониженной активностью гликогенолиза.
Дефицит глюкагона
Глюкагон — гормон, являющийся физиологическим антагонистом инсулина. Он участвует в регуляции углеводного обмена, влияет на жировой обмен, активируя ферменты, расщепляющие жиры. Основное количество глюкагона синтезируется альфа-клетками островков поджелудочной железы. Однако установлено, что специальные клетки слизистой оболочки двенадцатиперстной кишки и слизистой оболочки желудка также синтезируют глюкагон. При поступлении в кровоток глюкагон вызывает повышение в крови концентрации глюкозы, вплоть до развития гипергликемии. В норме глюкагон предотвращает чрезмерное снижение концентрации глюкозы. Благодаря существованию глюкагона, препятствующего гипогликемическому действию инсулина, достигается тонкая регуляция обмена глюкозы в организме.
При дефиците вышеперечисленных гормонов содержание инсулина снижено, а экскреция кетоновых тел с мочой повышена [4].
Роль печени в нарушении энергетического обмена
Печень участвует в поддержании нормального уровня глюкозы в сыворотке крови путем гликогеногенеза, гликогенолиза и глюконеогенеза. В основе нарушений обмена углеводов при болезнях печени лежат повреждения митохондрий, которые ведут к снижению окислительного фосфорилирования. Вторично страдают функции печени. При тяжелом остром гепатите, как правило, отмечается гипогликемия, а при циррозах печени это наступает в конечной стадии — при печеночной недостаточности [15]. Гипогликемия объясняется снижением способности печени (из-за обширного поражения ее паренхимы) синтезировать гликоген и уменьшением выработки инсулиназы (фермента, разрушающего инсулин).
Дефицит углеводов приводит также к усилению анаэробного гликолиза, вследствие чего в клетках накапливаются кислые метаболиты, вызывающие снижение рН. При циррозе печени может повышаться и уровень лактата в сыворотке крови в связи со сниженной способностью печени утилизировать его для глюконеогенеза.
При заболеваниях печени увеличивается роль жиров в качестве источника энергии. В печени происходят синтез жирных кислот и их расщепление до ацетил-КоА, а также образование кетоновых тел, насыщение ненасыщенных жирных кислот и их включение в ресинтез нейтральных жиров и фосфолипидов. Катаболизм жирных кислот осуществляется путем β-окисления, основной реакцией которого является активирование жирной кислоты с участием кофермента ацетил-КоА и АТФ. Освобождающийся ацетил-КоА подвергается полному окислению в митохондриях, в результате чего клетки обеспечиваются энергией.
При ряде заболеваний печени снижается и синтез липопротеидов, что ведет к накоплению триацилглицеридов с последующей инфильтрацией и жировой дистрофией печени. Причинами возникновения этого состояния, в частности, является недостаток в пище липотропных веществ (холина — составной части лецитина, метионина). Увеличивается образование кетоновых тел [4].
Итак, клиническая картина вторичного ацетонемического синдрома включает в себя непосредственно явления кетоза, признаки основного заболевания, на фоне которого развился кетоз, а также проявления того состояния, которое запустило патологический процесс (стресс, чрезмерная физическая нагрузка, инфекция и т. д.).
Ацетонемическая циклическая рвота
В практике приходится сталкиваться с идиопатической ацетонемической рвотой, которая протекает с кетоацидозом (ацетонемическая рвота, недиабетический кетоацидоз). В англоязычной литературе она входит в синдром идиопатической циклической рвоты [16, 17].
Патогенез ацетонемической рвоты полностью не выяснен. Предполагается, что у детей после перенесенных инфекционных заболеваний, травм черепа, органических заболеваний центральной нервной системы в течение длительного времени в гипоталамо-диэнцефальной области остается доминантный очаг застойного возбуждения, индуцирующий нарушения жирового обмена (усиление кетогенеза, нарушение нормального использования кетоновых тел в связи с истощением углеводных запасов в организме). В патогенезе ацетонемической рвоты могут иметь значение аномалии конституции, относительная несостоятельность энзимных систем печени, нарушения эндокринной регуляции метаболизма.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [18, 19]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38 [5]. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел, аммиака и β-изомасляной кислоты. Данные представления патогенетически сближают синдром циклической рвоты и синдром ацетонемической рвоты, а также объясняют необходимость и возможные пути метаболической коррекции.
Другие считают, что причиной резкого повышения кетоновых тел может быть недостаточное потребление детьми углеводов при избытке жиров и кетогенных аминокислот.
Кризы могут возникать внезапно с промежутками в несколько недель или месяцев. Провоцирующими факторами могут быть: нарушение диеты (жареные и печеные продукты), лихорадка, отказ от еды, физические и психические перегрузки.
Предвестниками синдрома циклической рвоты является анорексия, вялость или повышение возбудимости, тошнота, головные боли, абдоминальные боли, запах ацетона изо рта.
Затем появляется многократная или неукротимая рвота, которая может продолжаться от одного до пяти дней. Схваткообразные боли в животе усиливаются. Во время криза больной становится сонливым. В результате рвоты могут развиваться гемодинамические нарушения: тахикардия, мягкий пульс, приглушенность сердечных тонов, гипотония.
Печень умеренно увеличена. В некоторых случаях повышается температура. В выдыхаемом воздухе и рвотных массах ощущается запах прелых яблок. В моче высокая концентрация кетоновых тел. Приступы могут ликвидироваться спонтанно, без лечения.
Избыток кетоновых тел оказывает наркотическое действие на центральную нервную систему, что клинически проявляется вялостью, заторможенностью.
В биохимическом анализе крови обнаруживают нарушение липидного обмена (гиперхолестеринемию), тенденцию к гипогликемии, гиперкетонемию. В общем анализе крови: умеренный лейкоцитоз, нейтрофилез, ускоренная СОЭ.
В моче и выдыхаемом воздухе обнаруживается ацетон, в крови — повышенная концентрация кетоновых тел. На электроэнцефалограмме выявляются различные отклонения, не исчезающие полностью после прекращения приступа.
Этот синдром чаще встречается в дошкольном возрасте и сопровождается приступами многократной рвоты и кетонемии. У таких больных нередко выявляют повышенную возбудимость, мочекислую нефропатию, сахарный диабет, ожирение.
Кетоз при длительной рвоте, недоедании или голодании представляет классический компенсаторный процесс, призванный восполнить энергетический дефицит, точнее, недостаток углеводов, за счет альтернативных энергосубстратов кетокислот.
Диагноз синдрома ацетонемической рвоты можно подтвердить только после исключения других заболеваний, сопровождающихся рвотой: аппендицита и перитонита, энцефалитов, менингитов, начала отека головного мозга, отравления, токсикоза и инфекционных заболеваний и др. Но в первую очередь диабетического кетоацидоза.
Ацетонемические кризы у большинства детей прекращаются после 10–12 лет, но сохраняется большая вероятность развития таких патологических состояний, как подагрические кризы, вегетососудистые дистонии по гипертоническому типу, артериальная гипертензия.
Транзиторный кетоз у детей и подростков может выявляться при лихорадке, стрессах, инфекционных заболеваниях, голодании (во время болезни), употреблении богатой жирами пищи, напряженной физической активности. В этих случаях содержания кетоновых тел в моче не более 2+.
Лечение
Лечение и профилактика гиперкетонемии зависят от причины ее возникновения, но во всех случаях направлены на улучшение функции печени и нормализацию энергетического обмена. Это достигается ограничением содержания жира в пищевом рационе, назначением липотропных средств (метионина и др.), витаминов группы В, при необходимости — инсулина, кокарбоксилазы.
В период приступа синдрома циклической ацетонемической рвоты выраженная дегидратация, гиповолемия, метаболический ацидоз и электролитные нарушения — это основные факторы, которые определяют тяжесть состояния. Необходимо в первую очередь ликвидировать ацидоз: назначить промывание желудка и кишечника 1–2% раствором бикарбоната натрия. Антикетогенными свойствами обладает 5–10% раствор глюкозы, с добавлением необходимого количества инсулина, а также раствор Рингера [20].
Если питье не провоцирует рвоту, рекомендуется подслащенный чай, Регидрон, Оралит — частыми и небольшими объемами. После улучшения состояния и появления возможности приема жидкости назначается кормление ребенка. Диета должна содержать легкоусвояемые углеводы и ограниченное количество жиров (манная, овсяная, гречневая каши; картофельное пюре, печеные яблоки, сухари, сухое печенье).
Итак, выяснение механизмов развития кетонемического синдрома, выделение наиболее вероятных причин формирования кетоза дают возможность установить генез заболевания, а тем самым нормализовать состояние больного и предупреждать рецидивы кетонемии.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва