что значит кортико медуллярная дифференцировка нарушена
Что значит кортико медуллярная дифференцировка нарушена
Роль эхографии в дифференциальной диагностике доброкачественных и злокачественных лимфаденопатий.
Аббасова Е.В Пархоменко Р.А. Щербенко О.И.. Родионов М.В.
Лаборатория детской рентгенорадиологии РНЦРР, Москва
Адрес документа для ссылки: h ttp://vestnik.rncrr.ru/vestnik/v4/papers/ abbas_v4. htm
Проблема дифференциальной диагностики лимфаденопатий (ЛАП), в том числе у детей, является весьма актуальной, но она еще далека от разрешения. Актуальность данной темы исследования обусловлена многообразием нозологий, сопровождающихся лимфопролиферативным синдромом, а так же сложностью дифференциальной диагностики доброкачественных и злокачественных ЛАП. Биопсия лимфатического узла (ЛУ) была и остается завершающим этапом дифференциальной диагностики злокачественных и доброкачественных ЛАП, но показания к ее своевременному выполнению не определены и устанавливаются или эмпирически или при развернутой клинической картине заболевания (1, 2, 3, 7, 8).
Вместе с тем, за последнее десятилетие достигнут значительный прогресс в методах визуализации. Среди них ведущим, несомненно, является эхография. Повышение разрешающей способности эхографии в В-режиме позволило визуализировать ранее недоступные исследованию структуры. Так, если в недалеком прошлом удавалось оценить лишь размеры и общую эхогенность ЛУ, то в настоящее время появилась возможность детально исследовать их структуру, состояние ангиоархитектоники и другие, ранее недоступные параметры. [9, 10].
Однако, эхография в В-режиме на сегодняшний день не позволяет уверенно говорить о злокачественности. В связи с этим очевидны усилия по совершенствованию ультразвуковой аппаратуры и поиску новых ультразвуковых признаков, или набора признаков, которые позволили бы повысить показатели специфичности ультразвукового метода и тем самым сузить показания к биопсии ЛУ.
Несмотря на то, что эхография не может поставить гистологического диагноза, на основании ряда эхографических критериев, отображающих структуру ЛУ, определяются дальнейшие диагностические и терапевтические процедуры. Очевидно, что успехи лечения и прогноз заболевания, прежде всего, зависят от раннего выявления и своевременно начатой терапии [6].
На основании вышеизложенного нам представляется актуальным научное исследование по совершенствованию эхографического метода, в том числе определение места и роли новейших ультразвуковых технологий в дифференциальной диагностике лимфопролиферативного синдрома.
Материалы и методы
Общая характеристика наблюдавшихся больных.
Объектом анализа явились результаты комплексного обследования 241 пациента, у которых ультразвуковому исследованию (эхографии) подверглись 907 периферических ЛУ (табл. 1). Исследование проводилось с сентября 2000 года по сентябрь 2004 года. Возраст 174 обследованных пациентов (72 %) был менее 18 лет. Число лиц обоего пола было почти одинаковым: 121 женщина и 120 мужчин.
У 189 человек исследование проводилось в связи с наличием увеличенных ЛУ. В зависимости от окончательного диагноза данная группа была нами поделена на четыре подгруппы (см. также таблицу 1):
а) 109 больных имели реактивную лимфаденопатию неопухолевого генеза;
б) У 47 больных выявлены злокачественные опухоли системы гемопоэза;
в) У 17 человек имелись метастазы солидных новообразований в ЛУ;
г) У 16 человек выявлены различные, редко наблюдавшиеся в нашей практике заболевания.
Контрольная группа из 52 человек была представлена детьми и взрослыми без признаков периферической лимфаденопатии. В эту группу были включены школьники младших классов, обследованных в плане диспансеризации, а также дети и взрослые, обратившиеся за консультативной помощью в детское отделение РНЦ РР по поводу других заболеваний.
Кроме объективного исследования, анализу подвергались данные анамнеза жизни пациентов – такие, как особенности анте- и постнатального периода, в частности, указания на наличие у ребенка внутриутробной инфекции, хронической ЛОР-патологии, частоты и давности ОРВИ и других инфекционных заболеваний, контактов с инфекционными больными, туберкулезной инфицированности.
Таблица 1. Структура исследованных лимфаденопатий.
Болезнь кошачьей царапины
Острый лимфобластный лейкоз
Метастазы злокачественных опухолей
Метастазы солидных опухолей
Метастазы рака молочной железы
Метастазы рака головы и шеи
Общее количество узлов
Морфологическому исследованию было подвергнуто 253 ЛУ из 907 (28 %). Это было осуществлено путем эксцизионной биопсии 101 узлов с гистологическим и иммуногистохимическим (48 случаев) исследованием материала, трепанобиопсии с гистологическим исследованием материала из 4 ЛУ, цитологического исследования материала полученного путем тонкоигольной пункции 152 ЛУ, в том числе под контролем пальпации (83 узла) или под контролем ультразвукового исследования (69 узлов). Природа 651 увеличенных ЛУ у 82 больных устанавливалась на основании данных клинико-эхографического мониторинга, проводимого в сроки от 1 месяца до 1 года после первичного УЗИ, с учетом результатов лечения.
Обследование лимфатических коллекторов области головы и шеи производилось по общепринятой методике. Кроме того, впервые нами был использован дорзальный доступ, когда пациент располагался лежа на животе с максимальным сгибанием головы во фронтальной плоскости. При этом его подбородок максимально соприкасался с грудиной, а лоб упирался в кушетку. Такой способ, по нашим наблюдениям, позволял добиться максимальной фокусировки и улучшению визуализации эхоструктуры верхнешейных ЛУ.
В В-режиме оценивали распространенность поражения ЛУ по регионарным зонам, количество выявленных ЛУ, однотипность изменений эхоструктуры ЛУ. После этого проводился анализ изменений в каждом конкретном видимом эхографически ЛУ. При этом давалась оценка следующих параметров: линейные размеры максимального продольного и поперечного диаметра ЛУ; соотношение продольного и передне-заднего диаметров ЛУ (индекса Solbiati ); форма ЛУ (округлая, овоидная); возможность дифференциации составных частей ЛУ; толщина изображения сердцевины ЛУ (утолщена/истончена/не изменена)- обратно коррелирует с толщиной коры ЛУ; положение изображения сердцевины (обычное/смещено к периферии/деформировано); толщина коры ЛУ (истончена/утолщена/не изменена); общая эхогенность ЛУ (не изменена/снижена/повышена); эхоструктура ЛУ (не изменена/однородная/диффузно-неоднородная/наличие анэхогенных зон); наличие дополнительных гиперэхогенных включений в структуре ЛУ; состояние контуров ЛУ (четкие/нечеткие, ровные/бугристые); состояние окружающих тканей (не изменены/повышенной эхогенности/сниженной эхогенности).
Допплерография (Импульсноволновая допплерография, цветовое допплеровское картирование, энергетическое картирование (ЦД(Э)К) периферических ЛУ.
Для более полного исследования периферических ЛУ в 433 случаях из общего количества ЛУ (907), исследованных в В-режиме (48 %), мы применяли методики ультразвуковой ангиографии – Ц(Э)ДК. Из них в 353 случаях была выполнена импульсноволновая допплерография ( PW ) интранодальных сосудов с артериальным характером кровотока. P И в нашем исследовании проводилась по стандартной схеме исследования магистральных сосудов. В процессе исследования мы использовали линейный датчик с допплеровской частотой 7,5-10 МГц. Для исследования артерий и артериол области ворот использовалась стандартная шкала диапазона скоростей от 0 до 30,5 см/сек. При исследовании приводящих артериальных сосудов наблюдались следующие условия: проводилась корректировка положения датчика и направления допплеровской волны; допплеровский фильтр устанавливался на самые минимальные показатели.
Допплерографические признаки позволили оценить качественные характеристики васкуляризации: наличие или отсутствие интранодального кровотока, тип кровотока, тип интранодальной ангиоархитектоники. На основании обобщения данных литературы мы считаем целесообразным применить следующую классификацию типов сосудистой сети ЛУ по данным Ц(Э)ДК:
1) «хилусный тип», когда нам удалось визуализировать кровеносные сосуды в области ворот (хилуса) в виде единичных артериальных и /или венозных сосудистых фрагментов, без распространения в паренхиму узла и без ветвления;
2) «активированный хилусный тип», когда мы выявляли в той или иной мере хилусные сосуды и сосуды медуллярного слоя в виде «древовидных с ветвлением» венозных и артериальных сосудов (в литературе данный тип нередко обозначается как «центральный»);
3) «периферический тип» сосудистой внутринодальной сети соответствует сосудистым фрагментам локализованным по периферии ЛУ, в области коры ЛУ, преимущественно в подкапсульных отделах;
4) «смешанный кровоток» был представлен богатым кровоснабжением с цветовыми сигналами как в центре, так и по периферии узла. Мы выделили два варианта данного типа кровотока:
4а) в области ворот (хилуса) ЛУ располагается один крупный артериальный сосуд, по периферии единичные точечные цветовые сигналы фрагментов мелких сосудов;
Оценка достоверности различий полученных значений средней «М» и доли «Р» оценивалась с помощью критерия Student : « t » – доверительный коэффициент, уровень вероятности ошибки «р» в работе принят за 0,05, «Р»= 95%. Различия считались статистически достоверными при вероятности безошибочного прогноза р ≤ 0,05. Статистические показатели диагностических свойств параметров – информативность метода при уже определенных диагностических критериях, рассчитывалась по общепринятым формулам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Эхографические критерии периферических ЛУ в норме.
В анализируемой группе, в которой дети и подростки до 16 лет составляли 84%, при эхографии было выявлено 228 неизмененных периферических ЛУ.
При исследовании у большинства детей выявлялись мелкие ЛУ шейных, подмышечных и паховых групп. При этом 143 узла – (63% от общего количества неизмененных ЛУ) располагались в шейной области, а подмышечные и паховые составляли соответственно 53 (20%) и 37 (14%).
При исследовании аксиллярных и паховых областей дополнительно было выявлено 31 ЛУ (11,7% от нормальных ЛУ), которые имели эхографические признаки липоматоза. Такое изображение аксиллярных л/у было отмечено у женщин старшей возрастной категории после 35 лет и у подростков с нарушением жирового обмена. Остальные периферические ЛУ в контрольной группе пациентов не выявлялись, а их наличие расценивалось как патологическое.
Размеры выявленных неизмененных ЛУ в различных анатомических областях были разными, как и их форма: в наибольшем продольном диаметре от 4 до 27 мм (1,18±0,36 см )- и от 2 до 8 мм (0,468 ± 0,12) – в наименьшем поперечном диаметре. Большинство из них были непальпируемыми. Наиболее крупные ЛУ овальной формы были характерны для шейной зоны, очевидно, как зоны наибольшего антигенного раздражения, тогда как паховые и аксиллярные имели относительно меньшие размеры. Максимальный продольный диаметр югуло-дигастрального ЛУ Кютнера, расположенного в верхней трети шеи у взрослых и старших подростков, достигал 30 мм. Аксиллярные ЛУ встречались как овальной так и округлой формы, что, очевидно, связано с характером окружающих тканей и степенью их давления на ЛУ.
У детей ( 154 случая – младше 11 лет) наибольший продольный диаметр был достоверно меньше ( 1,10±0,31см), чем у взрослых( 49 случаев старше 16 лет- 1,34±0,47 см), р короткому диаметру было недостоверным в указанных возрастных группах, что, очевидно, связано с большей выраженностью лимфоидного компонента в ЛУ у детей в виде относительно боле толстого коркового слоя. Данное наблюдение подтверждается достоверной разницей индексов Solbiati у детей младше 11 лет и у лиц старше 16 лет. ЛУ в норме у детей были более округлой формы (индекс Solbiati детей 2,4± 0,05, у взрослых 2,9±0,125, p
Нами было изучено значение поперечного и продольного размеров ЛУ в констатации лимфаденопатии.
Диагноз ЛАП был правомочен, по нашим данным, при увеличении наименьшего поперечного диаметра шейных ЛУ у взрослых и подростков > 8 мм, у детей младшего школьного возраста >6 мм. Границей гиперплазии для паховых и аксиллярных ЛУ являлось значение передне-заднего диаметра у детей 5мм, у взрослых 8 мм соответственно. Увеличение размеров продольного диаметра по длинной оси лимфатического узла имело, по нашим данным, меньшее значение в постановке диагноза ЛАП.
В нижеследующей таблице представлены характерные признаки при некоторых группах ЛАП.
Таблица 2. Сравнительная характеристика эхографических признаков трех групп лимфаденопатий (ЛАП).
Узи почек: норма и расшифровка результатов
Ультразвуковое исследование почек в большинстве случаев является полноценным и достаточно информативным методом диагностики с целью определения заболевания и назначения адекватного лечения, а так же исключения патологии при скрининговых обследованиях.
Что показывает УЗИ почек?
При ультразвуковом исследовании почек УЗИ-аппарат позволяет определить следующие основные параметры:
Количество
В норме почки являются парным органом, но встречаются аномалии.
Возможно врожденное отсутствие почки – односторонняя аплазия (агенезия), либо утрата парности в результате хирургического удаления. Встречается врожденное удвоение почки, чаще одностороннее.
Аплазия левой почки
Удвоенная почка без признаков обструкции
Расположение
В норме почки расположены на разных уровнях относительно друг друга: правая (D) почка находится на уровне позвонков 12 грудного и 2 поясничного, левая (L) почка – на уровне позвонков 11 грудного и 1 поясничного.
На УЗИ можно выявить опущение почки (нефроптоз) или нетипичную локализацию органа (дистопия), вплоть до расположения в малом тазу.
В норме почка имеет бобовидную форму и ровный наружный контур с четкой визуализацией фиброзной капсулы в виде гиперэхогенной линии.
Размеры
Физиологической норме у взрослого человека соответствуют размеры почек:
Толщина слоя паренхимы – еще один очень важный параметр, в норме составляет 18-25 мм. Этот показатель зависит от возраста пациента: у пожилых людей он может уменьшаться до 11 мм в результате склеротических изменений. Паренхима является функциональной частью почки, в ней расположены структурно-функциональные единицы – нефроны. Увеличение показателя может быть признаком отека или воспаления почки, уменьшение свидетельствует о дистрофии органа.
У детей размеры почек зависят от возраста и роста ребенка. При росте до 80 см измеряются только два параметра – длина и ширина органа. У детей ростом 100 см и выше измеряется и толщина паренхимы.
В норме должна четко выявляться граница почечных пирамидок в паренхиматозном слое: эхогенность пирамидок ниже, чем паренхимы. При гидронефрозе дифференциация между ними отсутствует.
Увеличение размеров почки характерно для острого пиело- или гломерулонефрита, а так же если почка утратила парность и испытывает повышенную функциональную нагрузку.
Эхогенность паренхимы
Этот показатель определяет состояние почечной паренхимы, ее структуру. В норме она однородна.
Эхогенность – это степень интенсивности отражения звуковой волны от тканей: чем плотнее ткань, тем интенсивнее отражение и светлее изображение на мониторе. Ткани с низкой плотностью имеют слабую эхогенность и визуализируются темными участками. Жидкости и воздух анэхогенны.
К примеру, полостную кисту, содержащую жидкость, специалист описывает как анэхогенное образование. Гиперэхогенность характерна для склеротических процессов в почке (гломерулонефрит, диабетическая нефропатия, опухоли, амилоидоз).
Состояние полостной системы почек
Полостная система почек или чашечно-лоханочная система (ЧСЛ) выполняет функцию сбора мочи. На УЗИ могут диагностироваться следующие изменения:
Ультразвуковое изображение расширения полостных систем обеих почек у плода
В норме ЧЛС анэхогенна и не визуализируется. Камни размером 4-5 мм и более в УЗИ-заключении описываются как эхотень, гиперэхогенное включение, эхогенное образование. Наличие песка обозначается как микрокалькулез почек.
Состояние почечного кровотока
Для визуализации почечных кровеносных сосудов используют дуплексное сканирование (или допплерографию), при котором УЗИ-сканер выдает информацию в виде цветного изображения или спектрального графика. Методика является неинвазивной и безболезненной.
Исследование позволяет определить состояние сосудистой стенки, наличие внутрисосудистых обструкций и стенозов, определить скорость кровотока. В норме скорость может колебаться от 50 до 150 см/сек.
На цветовой схеме нормальными считаются темные тона. Яркий цвет фиксирует ускоренный кровоток и свидетельствует о наличии стеноза, основным признаком которого считается усиление кровотока в почечной артерии больше 200 см/сек.
Определяется индекс сопротивления кровотока или индекс резистентности, который напрямую зависит от возраста пациента: чем старше, тем выше скорость кровотока и выше индекс. В норме индекс сопротивления для почечной артерии – 0,7, для междолевых артерий – 0,34-0,74.
Кто проводит расшифровку результатов?
Расшифровку ультразвукового исследования почек должен проводить врач-уролог. К словесному заключению обычно прилагается фото УЗИ или сонограмма, где стрелками отмечается место выявленных патологических изменений.
При обнаружении опухолей или сосудистых изменений неплохо, если будет прилагаться видео УЗИ.
Какие заболевания выявляет УЗИ почек?
Ультразвуковая диагностика наиболее информативна относительно следующих почечных заболеваний и синдромов:
Если в заключении УЗИ почек значится «выраженный пневматоз кишечника», это означает неинформативность обследования по причине метеоризма и в этом случае УЗИ придется повторить после подготовки (употребление ветрогонных препаратов).
Видео:
УЗ анатомия почек
Порядок выполнения: ультразвуковое исследование почек
Подготовка к УЗИ почек
Определение стадии острого пиелонефрита для выбора лечебной тактики
В структуре заболеваний почек острый пиелонефрит (ОП) составляет около 14%. Гнойные формы развиваются у одной трети больных, нередко приводя к гибели почки (Пытель Ю.А., Золотарев И.И., 1985). При генерализации инфекции и развитии уросепсиса летальность достигает 80% ( Аляев Ю.Г. и соавт., 2008).
Таким образом, если раньше после 48-ми часов течения острого пиелонефрита предпринимались, как правило, открытые оперативные вмешательства, а на операционном столе выяснялось, что имела место лишь инфильтративная или даже серозная форма воспаления, то в настоящее время в арсенале уролога появились методы, диагностические возможности которых позволяют подходить избирательно к лечению разных стадий воспалительного процесса (Аляев Ю.Г. и соавт., 2008).
Уточнению роли различных высокоинформативных, современных инструментальных методов исследования (УЗИ с допплерографией, КТ с контрастированием, МРТ) в диагностике стадий ОП и изучению эффективности проводимого лечения в зависимости от клинической формы и стадии заболевания, посвящена данная работа.
Научная новизна
Практическая значимость
Установлено, что при выявлении серозной стадии ОП при помощи ультразвукового исследования в сочетании с допплерографией, проведение МСКТ или МРТ для уточнения диагноза необязательно. Выявлено, что УЗИ и УЗДГ не обладают достаточной информативностью для проведения дифференциальной диагностики между инфильтративной и гнойно-деструктивной стадиями острого пиелонефрита, в связи с чем больным с подозрением на формирование абсцесса почки настоятельно показаны МСКТ с контрастированием или МРТ. Доказано, что своевременное и адекватное дренирование мочевыводящих путей и правильно подобранная комплексная консервативная патогенетическая терапия в серозную и инфильтративную стадии ОП являются эффективным методом лечения.
Установлено, что при развитии острого пиелонефрита, осложненного абсцессом почки наиболее целесообразно применение чрескожной пункции и дренирования гнойника под ультразвуковым контролем и проведением комплексной консервативной патогенетической терапии. Данная тактика в современных условиях должна быть методом выбора. К открытому оперативному лечению необходимо прибегать при диффузных поражениях почки с формированием нескольких абсцессов, труднодостижимых для пункции с целью эвакуации гнойного содержимого или неэффективности пункционного дренирования.
Содержание работы
Большое значение в нашей работе уделено характеру острого пиелонефрита в плане его возникновения на фоне нарушенного или ненарушенного пассажа мочи по верхним мочевыводящим путям, так как этот фактор существенно влияет на алгоритм обследования и лечения. С учетом целей и задач нашего исследования 207 наблюдавшихся нами больных разделены на 3 группы. В 1-ю группу вошли 113 (54,6%) больных острым необструктивным пиелонефритом, во 2-ю – 30 (14,5%) больных острым обструктивным пиелонефритом и в 3-ю группу составили 64 больных (30,9%) острым пиелонефритом на фоне беременности от 18 до 36 недель.
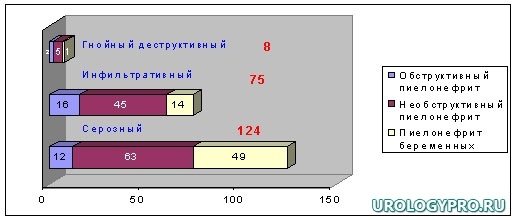
Распределение больных в зависимости от формы и стадии острого пиелонефрита представлено на диаграмме 1.
Диаграмма. 1. Распределение больных в зависимости от стадии острого пиелонефрита.
У 124-х больных (диаграмма 1) острый пиелонефрит нами диагностирован в серозную стадию, причем в 63 (50,8%) наблюдениях он имел необструктивный характер, в 12 (9,7%) – обструктивный и в 49-ти (39,5%) – возник на фоне беременности. У 75-ти больных острым инфильтративным пиелонефритом у 45-ти (60%) он имел необструктивный характер, в 16-ти (21,3%) – обструктивный и в 14-ти (18,7%) – развился на фоне беременности. Из 8-ми больных с тяжелыми гнойно-деструктивными формами заболевания, т.е. с наличием деструкции почечной ткани (абсцесс или карбункул), в 5-ти (62,5%) наблюдениях он носил необструктивный характер, в 2-х (25%) – обструктивный и в 1-ом (12,5%) – развился карбункул почки на фоне беременности.
Анализ клинико-лабораторных симптомов и данных экскреторных урограмм в большинстве наблюдений не позволил с достоверностью судить о клинической стадии болезни и с уверенностью выработать лечебную тактику, особенно когда решался вопрос о необходимости открытого оперативного лечения. Результаты экскреторной урографии мы всегда были вынуждены соотносить с клиническими проявлениями болезни и иными лучевыми методами обследования. Поэтому на начальном этапе нашего исследования мы пришли к выводу, что экскреторную урографию у больных ОП следует выполнять при отсутствии возможности применения КТ или МРТ. В дальнейшем при стадировании острого пиелонефрита мы старались сразу применять современные высокотехнологичные методы обследования, в основном УЗИ с допплерографией и МСКТ, которые позволяли дать оценку структурно-функциональному состоянию почечной паренхимы на принципиально ином, максимально приближенном к морфологическому, уровню диагностики.
Суммарные данные о количестве проведенных обследований у больных острым пиелонефритом в зависимости от характера нарушений уродинамики верхних мочевыводящих путей представлены в табл. 1.
Таблица 1. Распределение больных по видам проведенных исследований (n=207)
Всем 207 обследуемым больным острым пиелонефритом проведено УЗИ почек, 124 из них были в серозной стадии заболевания. Ультразвуковое исследование в В-режиме позволило выявить следующие признаки острого серозного пиелонефрита. Наиболее частым УЗ-признаком данной стадии являлся симптом «выделяющихся пирамидок», который установлен в 53 (42,7%) наблюдениях. Данный симптом обозначает повышение эхогенности почек за исключением области почечных пирамид, которые в результате выраженного отека, четко дифференцируются на остальном фоне. Остальные симптомы встречались несколько реже: утолщение почечной паренхимы преимущественно за счет медуллярного слоя, с незначительным снижением ее эхогенности в 42 (33,9%) и ограничение подвижности пораженной почки – в 34 (27,4%) наблюдениях. При этом следует отметить, что у 43 (37,9%) больных острым серозным пиелонефритом отмечено отсутствие каких-либо ультразвуковых признаков заболевания. Принимая во внимание клинико-лабораторные признаки болезни, мы считали, что неизмененные данные при эхографии почек являются признаком серозной стадии острого необструктивного пиелонефрита. УЗДГ-признаком острого серозного пиелонефрита в 62,1% наблюдений являлось усиление кровотока в проекции всех отделов сосудистой системы почки, так называемая «пылающая почка».
Острый инфильтративный пиелонефрит диагностирован у 75 больных. Выявляемость ультразвуковых признаков инфильтративной стадии острого пиелонефрита довольно высокая и колеблется от 66,7% до 86,7%. Наиболее специфичными УЗ-признаками данной стадии являются: нарушение кортикомедуллярной дифференцировки и появление зон пониженной эхогенности с нечеткими контурамизоны пониженной эхогенности в почке с четким контуром и нарушение корково-медуллярной дифференцировки. Суммарно УЗ-признаки острого инфильтративного пиелонефрита выявлены у 72 (96%) больных, отсутствовали у 3 (4%). Эходопплерографические признаки инфильтративной стадии ОП в виде практического отсутствия кровотока в зоне пониженной эхогенности с нечеткими контурами и усиления периферического сопротивления в огибающих сосудах выявлены у 34 (69,4%) из 49 обследованных больных.
Острый гнойно-деструктивный пиелонефрит с наличием деструкции почечной ткани (абсцесс или карбункул) установлен у 8 больных. Ультразвуковая картина при гнойной деструктивной стадии острого пиелонефрита чаще всего представленная гипоэхогенным очагом, имеющим округлую или овальную форму и четкий контур (абсцесс), выявлена в 7 (87,5%) наблюдениях. Иногда внутри данного очага определялись внутренние перегородки или дольки (карбункул) – 1(12,5%) наблюдение.
Допплерографической картиной гнойно-деструктивной стадии острого пиелонефрита мы считали аваскулярную зону внутри очага, которая свидетельствует о гнойном расплавлении ткани почки. Данный признак был выявлен у всех 8 (100%) больных в этой стадии.
Таким образом, в допплерографическом режиме (энергодопплерографии) на начальных этапах острого пиелонефрита (серозная стадия) у больных регистрируется усиление почечного кровотока. В дальнейшем могут выявляться зоны со сниженной перфузией, отмечается увеличение индекса резистентности по периферии, что связано с развитием вазоконстрикции при прогрессировании воспаления.
В серозной стадии острого пиелонефрита при МСКТ, как правило, мы определяли такие неспецифические признаки как увеличение размеров почки у 9 (34%) пациентов и толщины паренхимы у 12 (44%), нарушение кортико-медуллярной дифференцировки – у 12 (44%)пациентов.
При МСКТ с контрастированием в инфильтративную стадию острого пиелонефрита симптомы заболевания выявлялись наиболее часто, по сравнению с другими методами обследования (от 71,7 до 100%). При этом у всех 53 больных, которым произведена МСКТ, выявлялись зоны пониженной интенсивности накопления сигнала, чаще треугольной или клиновидной формы с нечеткими контурами. Как правило, эти изменения определялась в артериальную и паренхиматозную фазы. Мы связывали данные изменения со спазмом сосудов, обструкцией канальцев и интерстициальным отеком. Это предположение подтверждается тем, что вышеупомянутые области в результате антибактериальной терапии при повторном исследовании полностью исчезали и на их месте, в большинстве наблюдений, не образовывалась рубцовая ткань.
В целом КТ-признаки, характерные для инфильтративной стадии острого пиелонефрита нами выявлены у 75 больных: в 1-й группе – у 45 (60%), во 2-й – 16 (53,3%), в 3-й – у 14 (21,9%).
По данным МСКТ гнойно-деструктивная стадия острого пиелонефрита (абсцесс и карбункул), выявлена нами у 8 (100%) пациентов, благодаря обнаружению образования (зоны) с низкой (пониженной) интенсивностью сигнала округлой формы, не усиливающейся после введения контрастного вещества.
В инфильтративной стадии МРТ выполнена у 10 больных. При этом увеличение почки в размерах обнаружено у 7 (70 %) пациентов, утолщение почечной паренхимы – у 9 (90%). Основным критерием инфильтративной стадии острого пиелонефрита являлось появление в почечной паренхиме зон повышенной интенсивности МР-сигнала с нечеткими контурами на Т2 взвешенных и пониженной интенсивности на Т1 изображениях, выявленное у всех 10 (100%) пациентов.
Признаками абсцесса почки по данным МРТ считали негомогенные участки пониженной интенсивности с четким контуром на Т1-взвешенных изображениях и негомогенные участки с повышением интенсивности сигнала и четким контуром на Т2-взвешенных изображениях. При этом степень повышения интенсивности сигнала считали зависимым от содержания белка, жидкости и клеточного детрита в полости абсцесса. С помощью МРТ мы могли предполагать распространение гнойного процесса в паранефральное пространство.
Важным преимуществом МРТ является то, что этот метод нередко позволяет проводить дифференциальную диагностику между гнойным процессом в ткани почки и нагноением ее кист. Метод позволяет определить характер жидкости внутри кисты (серозная, геморрагическая, гнойная), что влияет на дальнейшую тактику лечения.
В целом МСКТ и МРТ при инфильтративной и гнойно-деструктивной стадиях острого пиелонефрита обладали наибольшей чувствительностью (100%) и специфичностью (100%).
На основании проведенного исследования нами выделены УЗ-, МР- и рентгеновские признаки острого воспаления почки на различных стадиях процесса. Основными УЗ-признаками являются снижение подвижности почки, увеличение почки в размерах, утолщение паренхимы, нарушение кортико-медуллярной дифференцировки. Обнаружение зон пониженной эхогенности с нечетким контуром свидетельствует об инфильтративных изменениях почечной паренхимы. Появление четкого ореола является более специфичным для абсцесса или карбункула почки. Основным допплерографическим критерием серозной стадии острого пиелонефрита мы считали усиление кровотока в проекции всех отделов сосудистой системы почки. При инфильтративных изменениях определяются гипоэхогенные очаги с резким обеднением кровотока. Отсутствие кровотока в четко очерченном участке паренхимы с резко сниженной эхогенностью свидетельствовует в пользу абсцесса или карбункула почки.
КТ-признаками острого пиелонефрита являются увеличение почки с утолщением ее паренхимы, нарушение кортикомедуллярной дифференцировки. Появление зон пониженной интенсивности накопления сигнала с нечетки контуром, преимущественно треугольной формы, свидетельствует об инфильтративной стадии процесса. Наличие зон пониженной интенсивности накопления сигнала округлой формы с четкими контурами указывают на гнойно-деструктивный процесс.
Основными МР-признаками острого пиелонефрита являются: увеличение почки (больше 12 см в продольном сечении), утолщение паренхимы (больше 2 см в среднем сегменте почки), нарушение кортико-медуллярной дифференцировки. Появление в почечной паренхиме зон повышенной интенсивности МР-сигнала с нечеткими контурами на Т-2 взвешенных и пониженной интенсивности на Т-1 взвешенных изображениях свидетельствует об инфильтративных изменениях в почечной паренхиме. При выявлении в почечной паренхиме зон повышенной интенсивности МР-сигнала с четкими контурами на Т-2 взвешенных и пониженной интенсивности на Т-1 взвешенных изображениях можно утверждать о формировании гнойно-деструктивных очагов.
Таким образом, современные методы лучевой диагностики (УЗ-допплерография, МСКТ, МРТ) позволяют дифференцировать интерстициальный отек, преобладающий на этапе серозного воспаления от диффузных и локальных инфильтративных изменений, а последние от гнойной деструкции почечной паренхимы. При этом на начальном этапе обследования всем больным выполняется УЗИ, в том числе с допплерографией. Комплексное УЗИ позволяет практически со 100% точностью диагностировать серозную и гнойно-деструктивную стадии острого пиелонефрита. Поэтому при серозной стадии заболевания обследование больных на этом этапе завершается и на основании клинико-лабораторных данных и результатов УЗИ в сочетании с допплерографией назначается соответствующая терапия. Одновременно за больным в обязательном порядке ведется динамическое наблюдение, которое может внести коррективы в дальнейшее ведение его. При выявлении инфильтративной стадии острого пиелонефрита, поскольку речь идет о дифференциальном диагнозе с гнойно-деструктивной стадией заболевания, целесообразно подтвердить диагноз с помощью МСКТ или у беременных с помощью МРТ, как более точных диагностических методик. При выявлении гнойно-деструктивной стадии ОП комплексным УЗИ обследованием диагноз, как правило, сомнений не вызывает. Однако поскольку в этой ситуации вопрос однозначно решается о том или ином оперативном методе лечения перед его выполнением в этих наблюдениях также целесообразно подтвердить диагноз с помощью МКСТ или МРТ.
Необходимо также отметить, что для уточнения диагноза (определения инфильтративной или гнойно-деструктивной стадий острого пиелонефрита) у большинства больных методом выбора, при наличии возможности выполнения, является МСКТ. Исключение составляют беременные с острым пиелонефритом, у которых методом выбора в дифференциальной диагностике этих стадий острого пиелонефрита является магнитно-резонансная томография.
В качестве антибактериальной терапии в серозной стадии острого необструктивного пиелонефрита мы использовали у 57 (90%) больных цефалоспорины 3 поколения, а защищенные аминопенициллины назначалсь лишь 6 (10%) пациентам. При серозной стадии острого необструктивного пиелонефрита всем 12 больным назначали только цефалоспорины 3 поколения.
При гестационном пиелонефрите в серозной стадии всем пациенткам мы дренировали мочевыводящие пути. При отсутствии дилатации чашечно-лоханочной системы мы ограничивались дренированием мочевого пузыря уретральным катетером на фоне антибактериальной и инфузионной терапии. При наличии дилатации ЧЛС всем пациенткам мы установили антирефлюксные мочеточниковые катетеры-стенты с дренированием мочевого пузыря уретральным катетером до нормализации температуры тела. В качестве этиотропной терапии в этой группе больных мы использовали у 39 (80%) больных цефалоспорины 3 поколения, у 10 (80%) защищенные аминопенициллины.
При лечении острого необструктивного пиелонефрита в инфильтративной стадии с целью антибактериальной терапии у 39 (87%) больных использовались препараты из группы карбапенемов, а у 6 (13%) цефалоспорины 3 поколения на фоне дренирования нижних мочевыводящих путей.
При остром обструктивном пиелонефрите в инфильтративной стадии после восстановления оттока мочи из почки из-за тяжести состояния больных нами 14 (87,6 %) больным антибактериальная терапия проводилась карбапенемами и 2 (12,5%) – цефалоспоринами 3 поколения
В лечении острого пиелонефрита беременных в инфильтративной стадии заболевания во всех 100% наблюдений мы использовали цефалоспорины 3 поколения.
В качестве антибактериальной терапии при гнойно-деструктивной стадии острого пиелонефрита после оперативного лечения мы использовали цефалоспорины 3 поколения у 2 (25%) и карбапенемы по тяжести состояния у 6 (75%).
Основным способом дренирования мочевых путей у подавляющего большинства больных острым серозным необструктивным пиелонефритом являлась установка уретрального катетера в мочевой пузырь, с целью исключения пузырно-мочеточникового рефлюкса как патогенетического фактора развития заболевания. У больных с пиелонефритом беременных этот способ дренирования мочевыводящих путей применен в 18% наблюдений.
Преимущественным видом дренирования мочевыводящих путей при серозной стадии острого пиелонефрита с обструктивным характером заболевания и у пациенток с острым пиелонефритом на фоне беременности являлась установка мочеточникового катетера-стента. В 3 наблюдениях острого обструктивного серозного пиелонефрита при технической невозможности установки мочеточникового катетера-стента дренирование почки осуществлено путем чрескожной пункционной нефростомии. Примененные нами методы дренирования мочевых путей при серозной стадии острого пиелонефрита приведены в табл. 2.
Таблица 2. Методы дренирования мочевыводящих путей больных острым пиелонефритом в серозной стадии (n=124)