что значит мутация раковых клеток
Мутации делают опухоли чувствительными к лечению
Чем больше в раковой клетке мутаций, тем проще иммунитету её поймать.
Разные раковые опухоли по-разному реагируют на лечение, даже если речь идёт о какой-то продвинутой иммунотерапии, вроде той, за которую в прошлом году дали Нобелевскую премию. В каких-то случаях опухолевые клетки удаётся довольно быстро истребить, в других случаях, наоборот, опухоль оказывается очень устойчива к терапии.
Методы лечения в онкологии чреваты побочными эффектами, и эффекты эти в случае иммунотерапии могут быть особенно чувствительны (потому что простимулированный иммунитет начинает атаковать не только больные клетки, но и здоровые). И понятно, почему исследователи всячески стараются найти способ заранее угадать, как опухоль будет реагировать на тот или иной способ лечения: если заранее будет известно, что, например, иммунотерапия не даст ничего, кроме побочных эффектов, то и не стоит её пробовать.
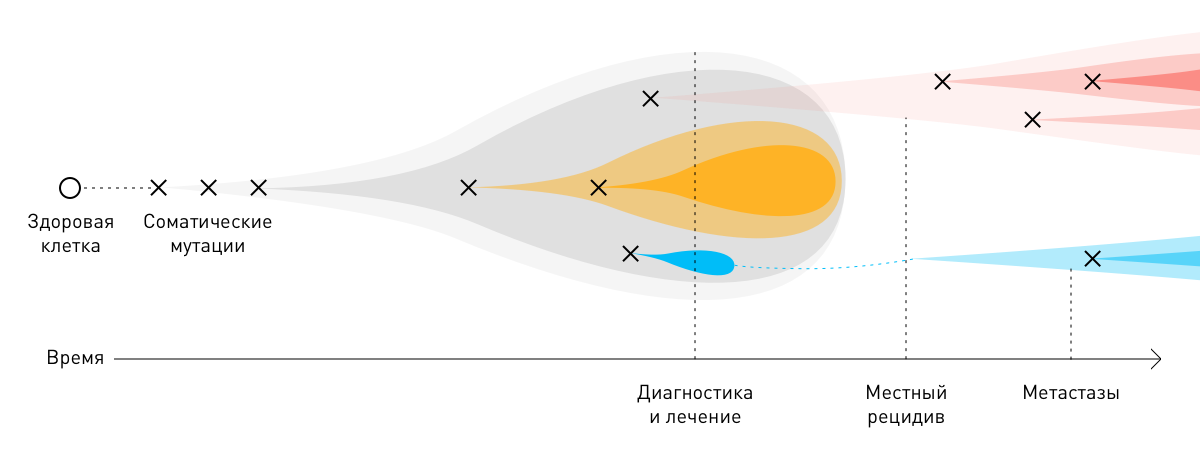
Иммунитет узнаёт злокачественные клетки потому, что они отличаются от здоровых, а отличаются они потому, что в них есть мутации. То есть, с одной стороны, именно из-за мутаций клетка начинает бесконтрольно делиться, но именно они делают её видимой для иммунных охотников. Причём генетических дефектов в раковых клетках бывает не одна, не две, а множество.
Можно предположить, что чем больше мутаций, тем сильнее клетка будет выделяться среди здоровых, и тем проще иммунной системе её обнаружить. Поскольку иммунотерапевтические методы обычно сводятся к тому, чтобы простимулировать иммунитет человека против опухоли, то, вероятно, такая терапия будет наиболее эффективной против опухолей с наибольшим числом мутаций.
Исследователи из Мемориального онкологического центра им. Слоуна–Кеттеринга проанализировали ДНК достаточно развитых опухолей более чем у 1600 пациентов, которым действовали на иммунные контрольные точки (то есть использовали тот самый нобелевский метод лечения, когда иммунитету, грубо говоря, отключают тормоза). Кроме того, опухолевую ДНК анализировали ещё более чем у 5300 больных, к которым эту терапию не применяли, но которые лечились другими способами. Виды опухолей были самые разные, от меланомы до рака груди.
Похожие исследования выполняли и раньше, но, как пишет портал Nature, на этот раз в работе использовали очень широкий спектр опухолей, которые к тому же брали у больных после разных видов терапии. В статье в Nature Genetics говорится, что лучше всего иммунная терапия действительно срабатывала с теми опухолями, в которых было больше всего мутаций. Но для разных видов рака это пороговое количество мутаций было разным. То есть терапию, в которой действуют на иммунные контрольные точки и отключают иммунные тормоза, нужно соотносить не с абстрактным числом мутаций, но ещё и с конкретным видом опухоли.
Правда, как мы знаем, мутация мутации рознь, не все они одинаковы и не все делают раковую клетку более видимой для иммунной системы. Поэтому, если говорить о клинических перспективах, то, наверно, чтобы мы точно могли угадать реакцию опухоли на лечение, нужно знать не только число мутаций, но и что они в раковой клетке делают.
Соматические мутации в опухоли
Мутация — любое изменение в молекуле ДНК либо структуре хромосом. Изменения, которые происходят в гаметах — половых клетках, называют герминальными, в любых других клетках организма — соматическими. Герминальные мутации передаются от родителей по наследству в виде генетических заболеваний. Соматические изменения не наследуются, а возникают в результате внешних воздействий (курения, радиоактивного излучения и других).
Доказано, что злокачественные опухоли в 90–95 % случаев возникают в результате соматических мутаций (спорадический рак). Наследственный рак, развивающийся в результате герминальных изменений, составляет 5–10 % от всех случаев заболевания.
Клеточные механизмы возникновения рака: протоонкогены и онкосупрессоры
Соматические мутации увеличивают шанс превращения здоровых клеток в раковые за счет активации онкогенов — генов, стимулирующих образование злокачественных опухолей. Онкогены образуются из обычных генов — протоонкогенов.
Деление клеток опухоли и разрастание опухолевой ткани тормозят антионкогены — гены-супрессоры. Протоонкогены и гены-супрессоры образуют систему стимуляции и подавления злокачественного процесса.
В подавляющем большинстве случаев раковые опухоли возникают из одной клетки в результате двух последовательных мутаций: первичной (герминальной) и вторичной (соматической). Для развития новообразования достаточно 3–6 таких повреждений. Вызванные ими изменения постепенно накапливаются в ДНК, вызывают неконтролируемое размножение пораженных клеток и образование атипичных тканей.
Драйверные соматические мутации и их использование для лечения злокачественных опухолей
В этиологии опухолей изменения в клетках вызывают ошибки копирования ДНК при делении — соматические драйверные мутации. В одних органах и тканях стволовые клетки делятся чаще, чем в других. В них злокачественные новообразования образуются чаще, чем в других структурах организма. По данным международного агентства по исследованию рака IARC, риск заболеть раком, а также выживаемость раковых клеток на 70–80 % зависят от интенсивности деления стволовых клеток и увеличиваются с возрастом.
Генетические маркеры опухолей (изменения в структуре белков в результате соматических драйверных мутаций) можно использовать как мишень и прицельно блокировать с помощью фармакологических препаратов. На этом принципе основан один из наиболее результативных современных методов лечения рака — таргетная терапия. Она позволяет:
Выявление драйверных соматических мутаций для диагностики злокачественных опухолей
Чем больше генетических маркеров известно, тем более адекватно подбирается лечение. Для выявления соматических мутаций при диагностике злокачественных опухолей используют следующие методики:
Целесообразность использования того или иного метода в каждом конкретном случае определяет врач.
Соматические мутации опухолей: влияние на диагностику и лечение
В процессе роста злокачественные новообразования приспосабливаются к факторам онкологического лечения — лучевой, химио- и иммунотерапии. Молекулы онкологических клеток, выжившие после того или иного лечебного этапа, нередко мутируют. Соматические мутации опухолей способствуют прогрессированию болезни и её более агрессивному (рецидивирующему и метастатическому) течению. Из-за индивидуальных различий на молекулярном уровне общеклинические стратегии лечения того или иного вида рака могут быть неэффективны для отдельных пациентов.
Чтобы максимально снизить риск рецидивов, улучшить качество жизни больных и увеличить её продолжительность, соматические мутации в опухолях в ответ на фармако- и химиотерапию необходимо учитывать. Для их выявления разработан инновационный метод исследования — молекулярное профилирование. Результаты этого вида диагностики позволяют врачу назначать наиболее оптимальное персонализированное лечение.
Молекулярно-генетическое исследование опухоли для подбора терапии
Молекулярно-генетические исследования опухоли помогают получить диагностические, предиктивные и прогностические данные для выбора эффективной терапии путем геномного профилирования опухоли. Онкогенотесты позволяют врачу подбирать индивидуальное лечение, диагностировать сложные случаи и предсказать возникновение наследственного рака.
Что определяет метод молекулярно-генетического тестирования опухоли?
Рост клетки контролируется как скорость автомобиля. Ряд генов кодирует молекулы, которые “давят на газ”. При мутации они не прекращают работу, заставляя клетку делиться без остановки. Другие гены кодирует молекулы-“тормоза”, и при их поломке деление клеток, становится неконтролируемым. Молекулярно-генетическое исследование опухоли позволяет обнаруживать такие мутации.
Мутации всегда наследуемы?
Большинство случаев рака вызывается приобретенными в течении жизни мутациями. Их вызывает контакт с, например, сигаретным дымом, радиацией, некоторыми химикатами. Некоторые мутации не имеют чёткой причины и происходят случайно, при делении клеток. Поэтому, даже если человек родился со здоровыми генами, некоторые из них могут измениться в течение жизни. Молекулярно-генетические методы позволяют выявить опухоль на ранней стадии благодаря обнаружению “поломок”.
Почему существует семейная предрасположенность к опухолям?
По современным представлениям, одной единственной мутации в клетке недостаточно. Однако, если пациент уже унаследовал мутацию от родителей, то это ускоряет накопление достаточного количества мутаций для появления злокачественного процесса. Благодаря онкогенотесту возможно узнать о наличии мутации до появления опухоли.
Какие виды исследований ткани опухоли существуют?
Исследования позволяют определить генетический и молекулярный профиль опухоли. Иммуногистохимический тест и флуоресцентная гибридизация in situ (FISH) помогают обнаружить “мутированные” клетки. Генетические тестирования опухоли (ПЦР, секвенирование) применяются для детального анализа последовательности ДНК и выявления мутации.
Какой материал опухоли исследуют?
Для проведения молекулярно-генетического исследования опухоли принимают фиксированный в формальдегиде материал после биопсии опухоли или её метастазов, а также готовые стекла и парафиновые блоки. О деталях процедуры уточнит специалист.
Как исследуют ткань опухоли?
Для чего применяется FISH-метод?
Флуоресцентная гибридизация in situ (FISH) по особому свечению помогает определить хромосомные аномалии в опухолевых клетках. Данное молекулярно-генетическое исследование применяется для обнаружения мельчайших генетических изменений, недоступных для нахождения иными способами.
Что представляет собой геномное профилирование опухоли?
Геномное профилирование опухоли заключается в “разложении на буквы” (секвенировании) ключевых онкогенов. Технология основана на выявлении генетических мутаций злокачественных клеток. В ходе комплексного профилирования выявляются все нарушения, которые могут быть связаны с онкологическими патологиями, оценивается их значимость.
Что такое таргетная терапия?
Это новое поколение противоопухолевых препаратов, которые атакуют конкретные “мишени”, запускающие опухолевый процесс. Лекарства действуют на пораженные клетки, не трогая здоровые. Для подбора терапии необходимо генетическое тестирование опухоли.
Можно ли назначать таргетное лечение без генетического тестирования опухоли?
Применение «таргетных» препаратов, действующих непосредственно на молекулярную мишень в опухолевой клетке, требует обязательного генетического тестирования, определяющих эффективность терапии. Как правило, доступные для атаки “мишени” несут не все опухоли, а лишь часть случаев. Поэтому нужно сначала обнаружить наличие “мишени” в опухоли, и только затем назначать препарат.
Каким пациентам показано исследование опухолевой ткани?
Исследование показано большинству пациентов для качественной диагностики и лечения, а также выбора терапии из нескольких вариантов; В сложных случаях (при затруднении диагностики или без выявленного первичного очага); Пациентам, которым перестало помогать лечение, назначенное ранее; Пациентам с диагностированным раком, для которого нет клинических стандартов лечения.
Если в образце ткани выявлена мутация, что делать далее?
После проведения комплексного молекулярно-генетического исследования, сбора и анализа всей информации и оформления заключения, пациент получит информацию, которая необходима врачу-онкологу для назначения или коррекции терапии с учетом информации о молекулярном и геномном профиле опухоли. Иногда значимых мутаций выявить не удается. Тем не менее, эта информация также будет полезна лечащему врачу при выборе тактики лечения и назначения дополнительных методов диагностики.
Что получает пациент после прохождения молекулярно-генетического исследования опухоли?
Пациент получает врачебное заключение с по генетическим нарушениям и молекулярным биомаркерам его опухоли, рекомендации по потенциально эффективным/неэффективным или токсичным препаратам.
Какую информацию получает врач по результату исследования?
Геномное профилирование опухоли позволяет врачу персонализировать лечение и получить результат лучше, чем стандартное лечение. Онкогенотест также помогает снизить риск осложнений при лечении и исключить неэффективные в конкретном случае препараты.
Помогают ли методы для прогноза текущего лечения и вероятности рецидива?
Конечно. Генетическое тестирование опухоли помогает выявить персональные риски и скорректировать текущее лечение в случае его неэффективности. После тестирования пациент узнает, повышен ли у него риск повторного заболевания, в каком органе, какие меры профилактики необходимо предпринять.
В чем преимущества геномного тестирования опухоли?
Геномное тестирование позволяет врачу-онкологу назначать эффективную терапию индивидуально для каждого пациента. Классическое назначение лекарств не уточняет персональный «вид» опухоли, а назначается или эмпирически, или «атакует» все клетки организма разом. Тестирование позволяет врачу опираться не на чаще назначаемые при данной патологии препараты, а выбирать препараты, которые при наличии мутации дадут положительный эффект.
Есть ли необходимость в сдаче крови?
Исследования на основе периферической крови возможны в том случае, если тканевая биопсия невозможна, количество опухолевой ткани является недостаточным для анализа или есть подозрения на метастазирование и прогрессирование. В таком случае производится геномное профилирование опухоли на основе образца крови. Также на основе крови осуществляется поиск наследственных и приобретенных мутаций для предупреждения заболевания.
Кому показан онкогенотест без наличия обнаруженной опухоли?
Онкогенотест важен для раннего выявления наследственных форм рака. Также тест будет важен лицам, перенесшим заболевание раннее или имеющим пороки развития. Не стоит забывать, что мутации могут возникать спонтанно в течении жизни, поэтому их раннее обнаружение позволяет не пропустить начало заболевания.
При генетическом тестировании целиком разбирается весь ген?
При генетическом тестировании исследуют только определенные участки генов, которые чаще всего «замечены» в наличии значимых мутаций. Нет необходимости «разбирать» ген целиком, так как цена исследования будет значительно выше, скорость выполнения дольше, а клиническая ценность остается сомнительной.
Существует ли возможность узнать свою предрасположенность к развитию опухолей?
Часть случаев рака имеют наследственную природу. Это значит, что человек унаследовал сломанный ген, повышающий риск заболевания. Геномное профилирование опухоли определяет наличие онкологической предрасположенности и заблаговременно проводит профилактические мероприятия по раннему выявлению опухоли здоровым людям с неблагоприятной наследственностью в генах, вовлеченных в канцерогенез.
Как генетическое тестирование выявляет предрасположенность к наследственным формам рака?
Тест проверяет известные гены, защищающие нас от рака, на наличие мутаций, и определяет риск появления заболевания. Часть случаев рака имеют наследственную природу.
Чем поможет раннее выявление предрасположенности к наследственным формам рака?
Стоит ли родственникам проходить генетическое тестирование при обнаружении у пациента опухоли?
Какой рак чаще всего является наследуемым?
Всего известно около девяти распространенных и множество редких онкологических заболеваний, вероятность развития которых увеличена у носителей наследственных мутации. К самым распространенным наследуемым формам относятся рак желудка, яичников, молочной, поджелудочной, щитовидной и предстательной желез, колоректальный рак, меланома.
Что позволяет заподозрить наследственную форму рака?
Можно задуматься о наследственной форме рака при возникновении нескольких случаев одного типа рака в семье. Также насторожить может возникновение рака в каждом из парных органов, или рак, нехарактерный для данного пола. Опухоль появляется чаще всего в более раннем возрасте, чем при «спонтанной» мутации. Несколько типов рака у родственника также могут помочь заподозрить наследственную форму.
Если у родителей нет онкологии, значит и у ребенка не будет наследуемого рака?
Список литературы
Wishart DS. Is Cancer a Genetic Disease or a Metabolic Disease?. EBioMedicine. 2015;2(6):478 479. Published 2015 May 23. doi:10.1016/j.ebiom.2015.05.022
K.V. Shelekhova, A.S. Konstantinov.Morphological methods of malignant tumors investigation. Практическая онкология. Т. 18, No4 – 2017
Vnencak-Jones, C., M. Berger, W. Pao. 2016. Types of Molecular Tumor Testing. My Cancer Genome
Sokolenko AP, Imyanitov EN. Molecular Diagnostics in Clinical Oncology. Front Mol Biosci. 2018;5:76. Published 2018 Aug 27. doi:10.3389/fmolb.2018.00076
Генетика и онкология: главные вопросы
Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.