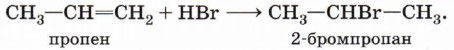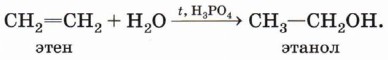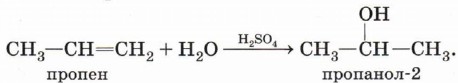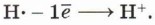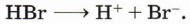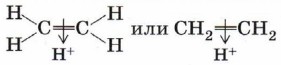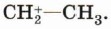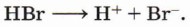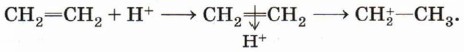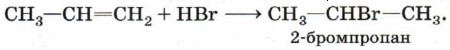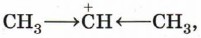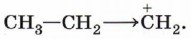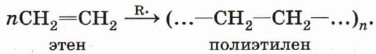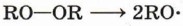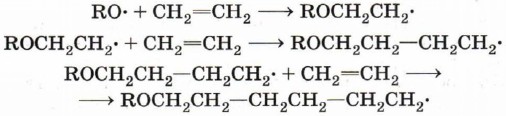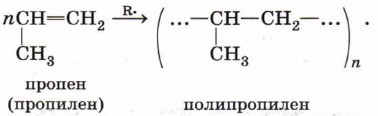что значит наиболее гидрированный атом углерода
Правила Марковникова
Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода (в месте разрыва двойной связи). Названо по имени его автора В. В. Марковникова и сформулировано им в 1869 году.
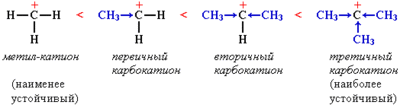
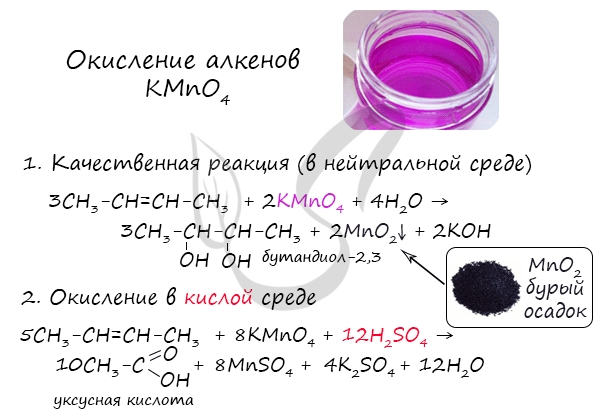
Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный заряд на атоме углерода:
Современная электронная трактовка правила Марковникова позволяет объяснить и ряд случаев присоединения против этого правила. Так, присоединение электрофильных и нуклеофильных агентов к соединениям с сопряжёнными связями, содержащим электроотрицательную группировку у атома углерода двойной связи, происходит против правила Марковникова в соответствии со смещением электронной плотности к наиболее электроотрицательным атомам, например:
Правило Марковникова нарушается также в реакциях присоединения HBr к олефинам в присутствии перекисей (эффект Хараша), так как механизм реакции в этом случае радикальный. Атакующей частицей является атомарный бром, а ориентация присоединения определяется стабильностью промежуточно образующегося углеродного свободного радикала:
Мнемоническое правило
Найдешь ли справедливость тут,
Где действуют двойные связи:
Где много водорода — так ещё дадут,
Где мало — так отнимут сразу!
Алкены
Номенклатура и изомерия алкенов
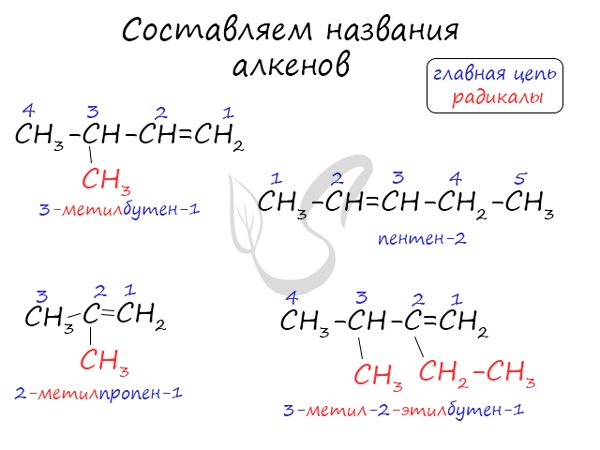
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
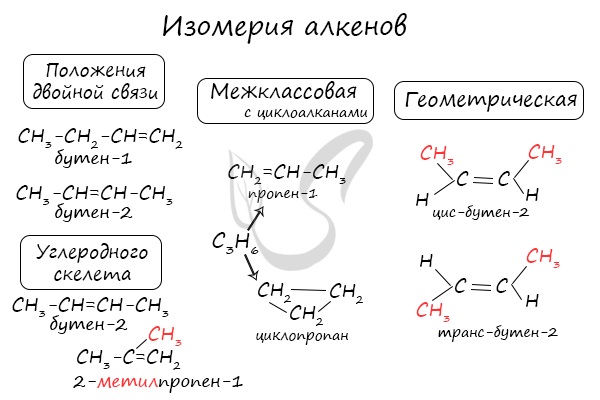
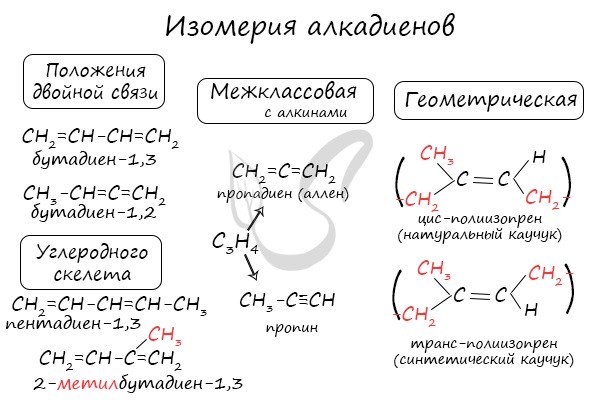
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
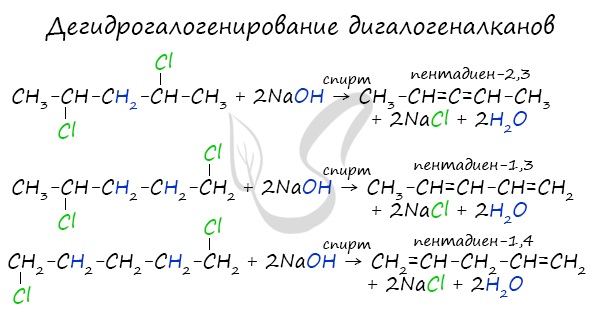
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
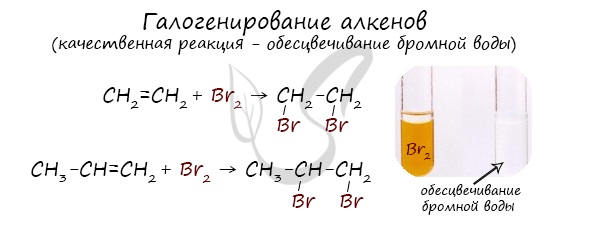
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
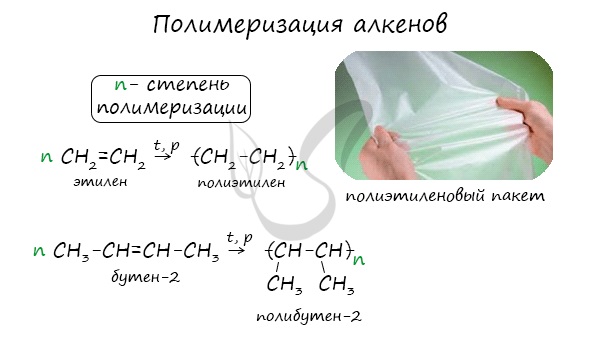
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкены
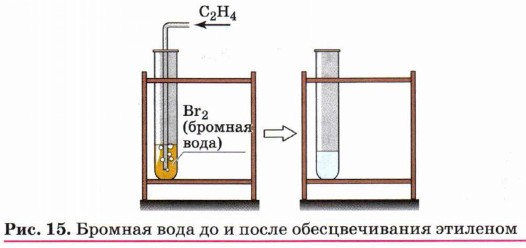
Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате
присоединения молекулы галогена к алкену и образования дигалогеналканов (рис. 15):
Реакция присоединения галогеноводорода более подробно будет рассмотрена ниже. Эта реакция подчиняется правилу Марковникова:
Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
Обратите внимание на то, что первичный спирт (с гидроксигруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные или третичные спирты:
Эта реакция также протекает в соответствии с правилом Марковникова — атом водорода присоединяется к более гидрированному атому углерода, а гидроксильная группа — к менее гидрированному.
Механизм реакций электрофильного присоединения
При этом катион имеет высокое сродство к электрону. Сочетание этих факторов делает катион водорода достаточно сильной электрофильной частицей.
Образование катиона водорода возможно при электролитической диссоциации кислот:
По этой причине многие электрофильные реакции идут в присутствии и с участием кислот.
Электрофильные частицы действуют на системы, содержащие области повышенной электронной плотности. Примером такой системы может являться кратная (двойная или тройная) углерод-углеродная связь.
Образовавшаяся частица называется карбокатионом, так как она содержит положительный заряд на атоме углерода.
Эта частица может соединиться с каким-либо анионом, частицей, имеющей неподелённую электронную пару, т. е. нуклеофилом:
Рассмотрим механизм электрофильного присоединения на примере гидробромирования (присоединения бромоводорода) этена:
Реакция начинается с образования электрофильной частицы — катиона водорода, которое происходит в результате диссоциации молекулы бромоводорода:
Карбокатион реагирует с нуклеофилом — бромидионом, образуя молекулу бромэтана:
Теперь рассмотрим более сложный случай.
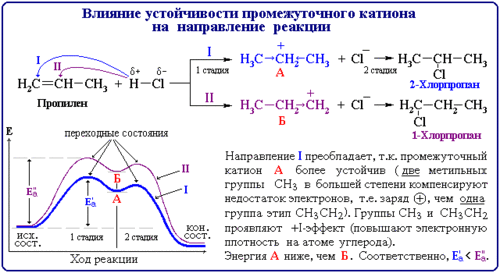
Присоединение бромоводорода к этену протекает однозначно, а взаимодействие бромоводорода с пропеном теоретически может дать два продукта: 1-бромпропан и 2-бромпропан. Данные эксперимента показывают, что в основном получается 2-бромпропан:
Чтобы объяснить это явление, нам придётся рассмотреть промежуточную частицу — карбокатион.
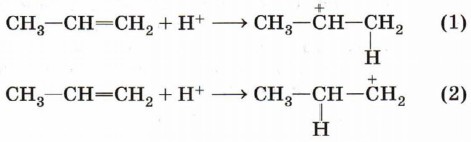
Присоединение катиона водорода к пропену может привести к образованию двух карбокатионов: если катион водорода присоединится к первому атому углерода (находится на конце цепи), то положительный заряд окажется у второго атома, т. е. в центре молекулы (1); если присоединится ко второму атому, то положительный заряд окажется у первого атома (2).
Преимущественное направление реакции будет зависеть от того, какого карбокатиона окажется больше в реакционной среде, что, в свою очередь, определяется устойчивостью карбокатиона. Эксперимент показывает преимущественное образование 2-бромпропана. Это означает, что в большей степени происходит образование карбокатиона (1) с положительным зарядом на центральном атоме.
Большая устойчивость этого карбокатиона объясняется тем, что положительный заряд на центральном атоме углерода компенсируется положительным индуктивным ( +I ) эффектом двух метильных групп:
Повышенная устойчивость карбокатиона (1) объясняется и пространственным фактором: атом углерода, несущий положительный заряд, с двух сторон защищён объёмными метильными группами.
Закономерности реакций гидрогалогенирования алкенов были изучены известным русским химиком В. В. Марковниковым, учеником А. М. Бутлерова, который, как это уже было сказано выше, сформулировал правило, носящее его имя.
Это правило было установлено эмпирически, т. е. опытным путём. В настоящее время мы можем привести вполне убедительное его объяснение.
Интересно, что правилу Марковникова подчиняются и другие реакции электрофильного присоединения, поэтому будет правильно сформулировать его в более общем виде:
Полимеризация алкенов
Особым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Эта реакция может протекать по механизму свободнорадикального присоединения, например:
При температуре 100 °С и давлении 100 МПа происходит гомолиз неустойчивой кислород-кислородной связи и образование радикалов — инициаторов полимеризации.
Под действием радикалов RO- происходит инициирование полимеризации, которая развивается как реакция свободнорадикального присоединения.
В общем виде уравнение развития цепи можно записать следующим образом:
Рост цепи прекращается, когда в реакционной смеси происходит рекомбинация радикалов — полимерной цепи и радикалов RO• или ROCH2CH2•.
Реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, используют для получения различных высокомолекулярных соединений:
Использование в качестве исходных веществ различных органических соединений, содержащих непредельный фрагмент —СН=СН2 (эту группу называют винил), даёт возможность синтезировать богатый ассортимент полимерных материалов с заданным набором полезных свойств:
Алкадиены
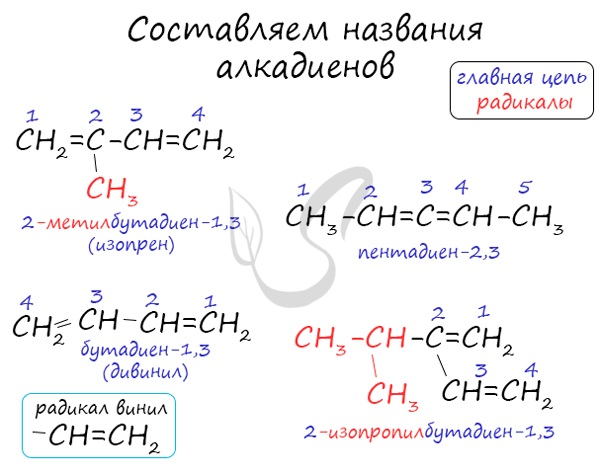
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
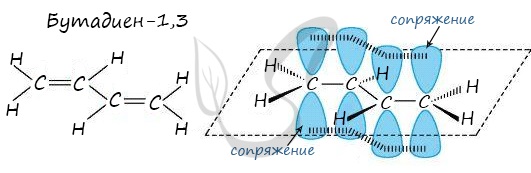
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
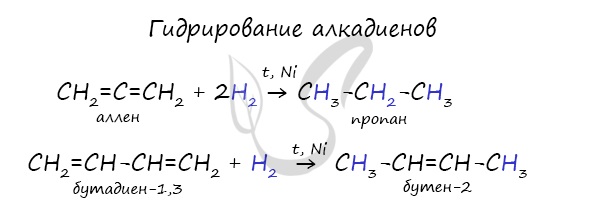
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
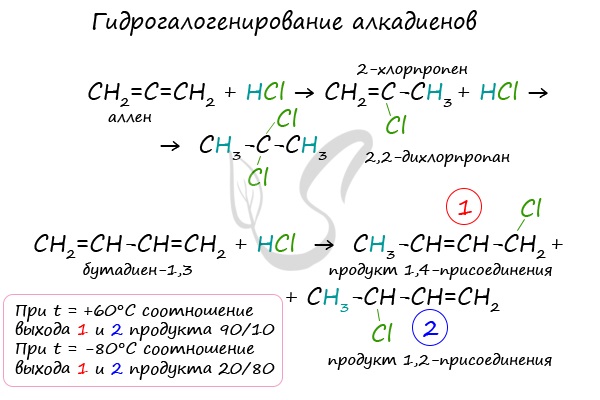
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что значит наиболее гидрированный атом углерода
Тема 2. Углеводороды
Соединения углерода с водородом, имеющие нормальные (неразветвленные) и разветвленные цепи, носят название «алканы» (синонимы – парафины (устар.), алифатические углеводороды, насыщенные углеводороды).
2.1.1. Физические свойства
Метан, этан, пропан, бутан в нормальных условиях – газы; пентан, гексан, гептан – жидкости и т.д.
С увеличением числа атомов углерода температура кипения возрастает. При одинаковом количестве атомов углерода в молекулах изомеров алканов температура кипения падает с увеличением степени разветвленности молекулы, а температура плавления, напротив, возрастает (вследствие более компактной упаковки «сферических» молекул разветвленных алканов в кристаллической решетке). Чем симметричнее построена молекула, тем легче и прочнее ее упаковка в кристалл и тем выше температура плавления. Факторы, влияющие на температуру кипения, меньше сказываются на температуре плавления, так как при плавлении силы Ван-дер-Ваальса лишь незначительно ослабляются.
Алканы нерастворимы в воде, ограниченно смешиваются с метанолом и этанолом. Чистые алканы не обладают запахом. Специфический запах бензину, керосину и дизельному топливу придают примеси. Характерный запах природного и сжиженного газов обусловлен тем, что в них специально добавляют примеси сернистых соединений углеводородов (тиоспирты и тиоэфиры), чтобы облегчить определение утечек газа без специальных приборов, т.е. органолептически. Запах сернистых соединений ощущается уже при очень малых их количествах.
Для наименования алканов используется как тривиальные названия, так и систематическая (IUPAC) и рациональная (заместительная) номенклатуры.
Первые четыре члена гомологического ряда алканов (метан, этан, пропан и бутан) имеют тривиальные названия. Тривиальные названия имеют и некоторые другие соединения, например, изооктан (2,2,4-триметилпентан) и неопентан (2,2-диметилпропан).
Наименования линейных молекул алканов с числом атомов углерода 5 и более образуются от имен греческих числительных (пентан, гексан, гептан, октан, нонан и декан – соответственно С5, С6, С7, С8, С9 и С10). Алканы с числом атомов углерода от 11 до 19 носят наименования с приставкой декан (соответственно, ундекан С11, додекан С12, тридекан С13, тетрадекан С14, пентадекан С15, гексадекан С16 и т.д.), а начиная с 20 атомов углерода – козаны (эйкозан С20, генэйкозан С21, докозан С22, трикозан С23, тетракозан С24, пентакозан С25, гексакозан и т.д.).
Углеводороды с числом атомов углерода в молекуле 30–39 называют триаконтанами (триаконтан С30, гентриаконтан С31, дотриаконтан С32, тритриаконтан С33, тетратриаконтан С34 и т.д.).
2.1.2.1. Правила наименования по номенклатуре IUPAC
1. В молекуле отыскивается наиболее длинная цепь из углеродных атомов, вне зависимости от того, в каком направлении она располагается, куда «поворачивает» и т.д. Если таких самых длинных цепей (путей) окажется два варианта, выбирают тот, который включает максимальное число заместителей:
2. Цепь нумеруют с того края, куда ближе заместитель. Поскольку определение этого условия «на глаз» достаточно субъективно, следует пользоваться простым правилом – верным следует считать тот порядок нумерации атомов углерода цепи, который приводит к минимальной сумме номеров заместителей. Если цепь имеет два разных заместителя, каждый из которых равноудален от «своего» края цепи, цепь нумеруют от заместителя, чье название по алфавиту начинается раньше. При этом приставки изо-, втор- и трет- не учитываются:
4. Заместители перечисляют в алфавитном порядке (бутил, метил, пропил, этил и т.д.). Название формируется перечислением номеров заместителей, их наименований и завершается названием углеводорода, образующего самую длинную выделенную цепь.
2.1.2.2. Рациональная (заместительная) номенклатура
По этой номенклатуре выделяют метановое (или этановое) звено в структуре соединения и перечисляют заместители, дополняющие структуру:
Ясно, что применение рациональной номенклатуры ограничено сравнительно несложными по структуре соединениями.
2.1.2.3. Классификация заместителей
В ссылку – таблицу, в отдельное окно