что значит толерантная иммунная система
Интервью с иммунологом клиники ЕвроМед
Главный защитник нашего организма – иммунитет, именно он отвечает за то, как мы себя чувствуем, часто ли болеем, как сопротивляемся бактериям, вирусам. При нарушении работы иммунной системы может возникнуть немало неприятных состояний, самое частое заболевание, развивающееся из-за сбоя иммунной системы — аллергия. Именно про иммунитет, особенности его работы, способы укрепления, а также об аллергии и профилактике ее появления мы поговорим сегодня с кандидатом медицинских наук, аллергологом-иммунологом Юлией Борисовной СЕЛИХОВОЙ.
Аллергия – достаточно молодое заболевание, сам термин появился только в 1906 году. Несмотря на то, что единичные проявления аллергических реакций отмечались и древними учеными, наиболее интенсивный рост заболеваемости наблюдается в последние десятилетия. Существует несколько теорий возникновения аллергии, но все они сводятся к одному – аллергия связана с развитием цивилизации. Проведенные исследования показывают, что иммунологические и аутоиммунные заболевания гораздо чаще встречаются в развитых странах по сравнению со странами третьего мира, в крупных промышленных городах по сравнению с небольшими поселениями.
С одной стороны – мы дышим загрязненным воздухом, постоянно растет употребление продуктов химической промышленности, лекарственных препаратов, которые как сами вызывают аллергию, так и могут создавать предпосылки для ее развития, нарушая функции различных внутренних органов и систем. Доступные продукты питания содержат огромное количество стабилизаторов, ароматизаторов, консервантов, ГМО, антибиотиков и пр. Мы поглощаем это все ежедневно, что не проходит бесследно для нашего организма. Способствуют развитию аллергии и хронические заболевания пищеварительного тракта, стрессы.
С другой стороны, к причинам такого роста аллергических – и не только аллергических заболеваний, можно отнести постепенное исчезновение естественного отбора. В природе предусмотрены механизмы ограничения выживаемости слабых особей и соответственно уменьшения вероятности появления от них потомства. Развитие современных медицины позволяет во многих случаях противостоять естественному отбору. В результате сейчас благодаря репродуктивным технологиям беременность достигается и в случаях длительного бесплодия, врачи спасают новорожденных детей весом от полукилограмма, детей с тяжелыми патологиями развития. И тут палка о двух концах – в каждом частном случае людям дарят счастье рождения ребенка, но, в целом, на общей заболеваемости в популяции это сказывается соответствующим образом. Природа есть природа, и все наши вторжения не проходят бесследно.
И еще одна важная причина роста аллергических заболеваний — мы слишком сосредоточились на гигиене, создавая практически стерильные условия для жизни – особенно для маленьких детей – именно в тот период, когда они должны по максимуму контактировать с аллергенами, чтобы выработать к ним иммунитет. Доказано, что снижение инфекционной заболеваемости, особенно в раннем возрасте (в результате изоляции детей, вакцинации, улучшения социально-экономических условий, развития санитарной культуры, чрезмерной дезинфекции), сопровождается возрастанием аллергической заболеваемости. Необоснованная антибиотикотерапия также вносит свой вклад. Антибиотики прописывают и беременным, и новорожденным детям – в самый важный период формирования иммунитета. Разумеется, нельзя говорить, что антибиотики – это абсолютное зло, но принимать их нужно только при наличии строгих медицинских показаний.
Мы настолько защищаем детей от любой инфекции, что он растет в практически стерильных условиях, и иммунитету приходится искать другое направление, где бы ему проявить свою активность. Аллергия — это гипериммунная реакция, реакция иммунитета относительно абсолютно безвредных белковых молекул, которые в норме никакой угрозы не представляют для человека. Но иммунитет с ними борется, пытаясь защитить наш организм, хотя это нецелесообразно.
Есть ряд инфекций, так называемых «детских», которыми лучше переболеть именно в детстве – они и переносятся легче, и способствуют корректной работе иммунитета. Есть данные, показывающие, что младшие дети в семье, дети, посещающие дошкольные учреждения, реже страдают от аллергии. Именно потому что у них больше контакта с инфекциями, с разнообразными антигенами.
Аналогично и в отношении к домашним животным – не нужно детей изолировать от них. Чем раньше ребенок начнет контактировать с животными, тем ниже риск развития аллергии на шерсть, эпителий и другой биологический материал. Причем раньше – это с рождения, а не в год–два.
АЛЛЕРГИЯ (греч. allos другой + ergon действие) — повышенная чувствительность организма к воздействию некоторых факторов окружающей среды (химических веществ, микроорганизмов и продуктов их жизнедеятельности, пищевых продуктов и др.), называемых аллергенами. Аллергия приводит к развитию аллергических заболеваний.
Термин «аллергия» был предложен австрийским педиатром Пирке (С. Р. Pirquet) в 1906 г. для обозначения необычной, измененной реакции некоторых детей на введение им с лечебной целью противодифтерийной сыворотки.
Аллергические заболевания известны с древних времен. Древнегреческий врач Гиппократ (V–IV вв. до н. э.) описывал случаи непереносимости некоторых пищевых продуктов его пациентами. Древнеримский врач Гален (Galenus, II в. н. э.) отмечал насморк, возникающий от запаха розы. В XIX в. была описана сенная лихорадка и доказано, что ее причиной является вдыхание пыльцы растений; было высказано также предположение, что при возникновении бронхиальной астмы может иметь значение вдыхание пыли.
Аллергические заболевания широко распространены во всем мире и имеют тенденцию к росту. Распространенность их в разных странах составляет от 10 до 50%.
Наиболее распространенные аллергены
В младенческом возрасте, чаще всего возникает атопический дерматит. Это как правило пищевая аллергия. Позже, ближе к школьному возрасту присоединяется респираторная аллергия — на находящиеся в воздухе аллергены. Начинается она обычно с ринита, и часто далее трансформируется в бронхиальную астму. Такая возрастная последовательность получила название «атопический марш».
Детская аллергия может пройти со временем. Какие-то минимальные проявления пищевой непереносимости — это нормально в младенчестве и детском возрасте. Во многих развитых странах атопический дерматит у маленьких детей вообще не лечат, так как вероятность его самостоятельного обратного развития, спонтанной ремиссии очень высока.
К сожалению, бывает, что аллергия со временем, наоборот, переходит в более тяжелые хронические формы.
Это зависит от генетической предрасположенности, образа жизни, питания ребенка. Роль генетических факторов первостепенна. При этом имеет значение не только генотип родителей, но может быть и своя генетическая мутация. Но можно однозначно утверждать, что если родители страдают от аллергии, то риск развития аллергии у ребенка значительно выше.
Это устаревшее мнение. Действительно, раньше, буквально еще 3–5 лет назад, считалось, что беременной, а уж тем более кормящей маме надо соблюдать строгую гипоаллергенную диету.
Сейчас изменилась тактика практически на противоположную. Считается, что чем раньше ребенок — даже внутриутробно — проконтактировал, познакомился с аллергенами, тем лучше он будет их переносить в дальнейшем. Тут главное — не перестараться с количеством. В рационе беременной и кормящей мамы понемногу должно присутствовать всё: ягоды, цитрусовые, помидоры, рыба и т. д. (разумеется, при условии, что женщина сама нормально переносит эти продукты). Исключать ничего не нужно.
Есть такое понятие, как «окно толерантности»: это период с 3 до 8–9 месяцев после рождения ребенка, в который он наиболее благоприятно может усваивать новые аллергены. То есть в это время ребенок должен знакомиться с максимальным количеством аллергенов. Неслучайно именно в этот период рекомендуют начинать вводить прикорм. Педиатры считают, что до года ребенок должен уже познакомиться со всеми основными группами продуктов. Опять же повторюсь: делать это надо без фанатизма, по чуть-чуть, но обеспечить контакт с разнообразными аллергенами необходимо.
Весь смысл вакцинации заключается именно в стимулировании иммунитета. Вакцина — это, как правило, антиген – частица микроорганизма, от которого мы хотим защититься. Этот антиген, являясь чужеродным элементом, попав в организм человека, стимулирует выработку защитных антител. Лимфоциты, продуцирующие эти антитела, далее циркулируют в виде клеток памяти длительно, иногда пожизненно. Этим обеспечивается защита о реальной инфекции в случае встречи с полноценным живым микроорганизмом.
При вакцинации формируется специфический иммунитет – только против конкретного вида патогена, работа остальной иммунной системы практически не затрагивается. В редких случаях вакцина защищает не только от конкретного вируса, скажем, гриппа, но и от некоторых других респираторных вирусов. Для развития такого перекрестного иммунитета необходима определенная схожесть антигенов микроорганизмов.
Но дебаты на тему целесообразности вакцинации не умолкают в связи с существующим все же риском развития поствакцинальных осложнений и ее вероятной ролью в развитии аллергизации.
Самое главное, как мы уже не раз говорили, это образ жизни: закаливание, регулярные физические нагрузки, сбалансированное питание, полноценный сон и позитивный жизненный настрой. Многочисленные исследования доказывают, что всё это оказывает прямое иммуностимулирующее воздействие. Мечта многих о волшебной таблетке для иммунитета, к сожалению, несбыточна.
Ну и разумеется, на состояние нашей иммунной системы напрямую негативно влияют наши вредные привычки: курение и чрезмерное употребление алкоголя.
Необходимо периодически, особенно в холодное время года принимать дополнительно моно- или поливитамины, омега-3полиненасыщенные жирные кислоты, – конкретные препараты вам поможет подобрать врач.
Современный российский фармацевтический рынок переполнен иммуномодуляторами. Такой ситуации нет ни в одной другой стране. Это вызывает тревогу и компрометирует направление иммунотерапии.
Иммуномодуляторы может назначить только врач и только при наличии соответствующих показаний – серьезного ослабления иммунитета. Иммунограмма часто помогает врачу определиться с тактикой, но не отражает состояние всех тонких механизмов работы иммунной системы.
Существует ряд признаков ослабления иммунитета, если вы замечаете их у себя, обязательно посетите иммунолога.
Признаки ослабления иммунитета:
Иммунолог, скорее всего, назначит иммунограмму – специальный анализ крови, по которому оценивается работа иммунитета. Иммунограмма помогает врачу определиться с тактикой, но не отражает состояние всех тонких механизмов работы иммунной системы. Клиническая картина имеет первостепенное значение. Только врач сможет оценить и результат анализов, и общее состояние организма, подобрать адекватный лекарственный препарат, который действительно поможет. Самостоятельно это сделать очень сложно.
ИММУНИТЕТ
Иммунитет или иммунная система – это сложная система организма, которая защищает его от всех чужеродных веществ извне, и контролирует уничтожение вышедших из строя или устаревших собственных клеток. Защита организма осуществляется на многих уровнях.
Функции иммунной системы: сохранять постоянство внутренней среды организма, сохранять невосприимчивость к различным инфекционным микроорганизмам, вирусам, паразитам, другим чужеродным агентам, способным привести к генетическим сбоям.
Иммунитет условно можно разделить на два типа: неспецифический и специфический.
Неспецифический (врожденный) иммунитет передается нам с генами родителей. На этот тип иммунитета приходится более 60% всей защиты нашего организма. Его формирование у плода начинается в середине первого триместра беременности.
Неспецифический иммунитет действует просто и эффективно: обнаружив антиген, он атакует его и уничтожает.
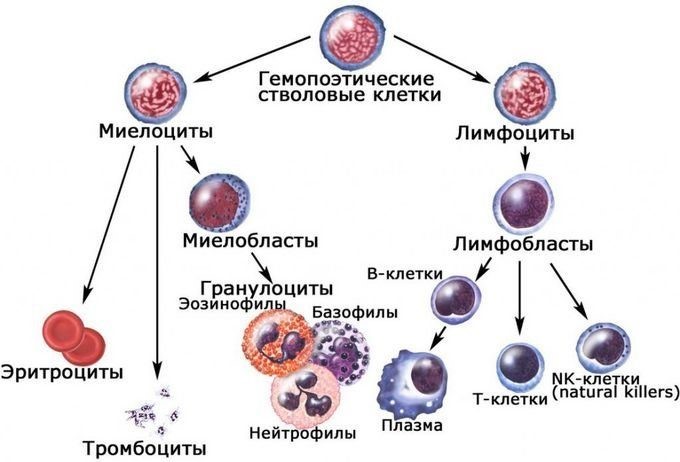
Специфический иммунитет начинает формироваться в то же время, что и неспецифический, и из того же материала – стволовых клеток. Клетки неспецифического иммунитета становятся антителами к разнообразным заболеваниям. Чем с большим количеством микроорганизмов встречается иммунная система, тем большее количество антител имеется в ее арсенале для борьбы с разными болезнями и тем крепче становится специфический иммунитет.
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
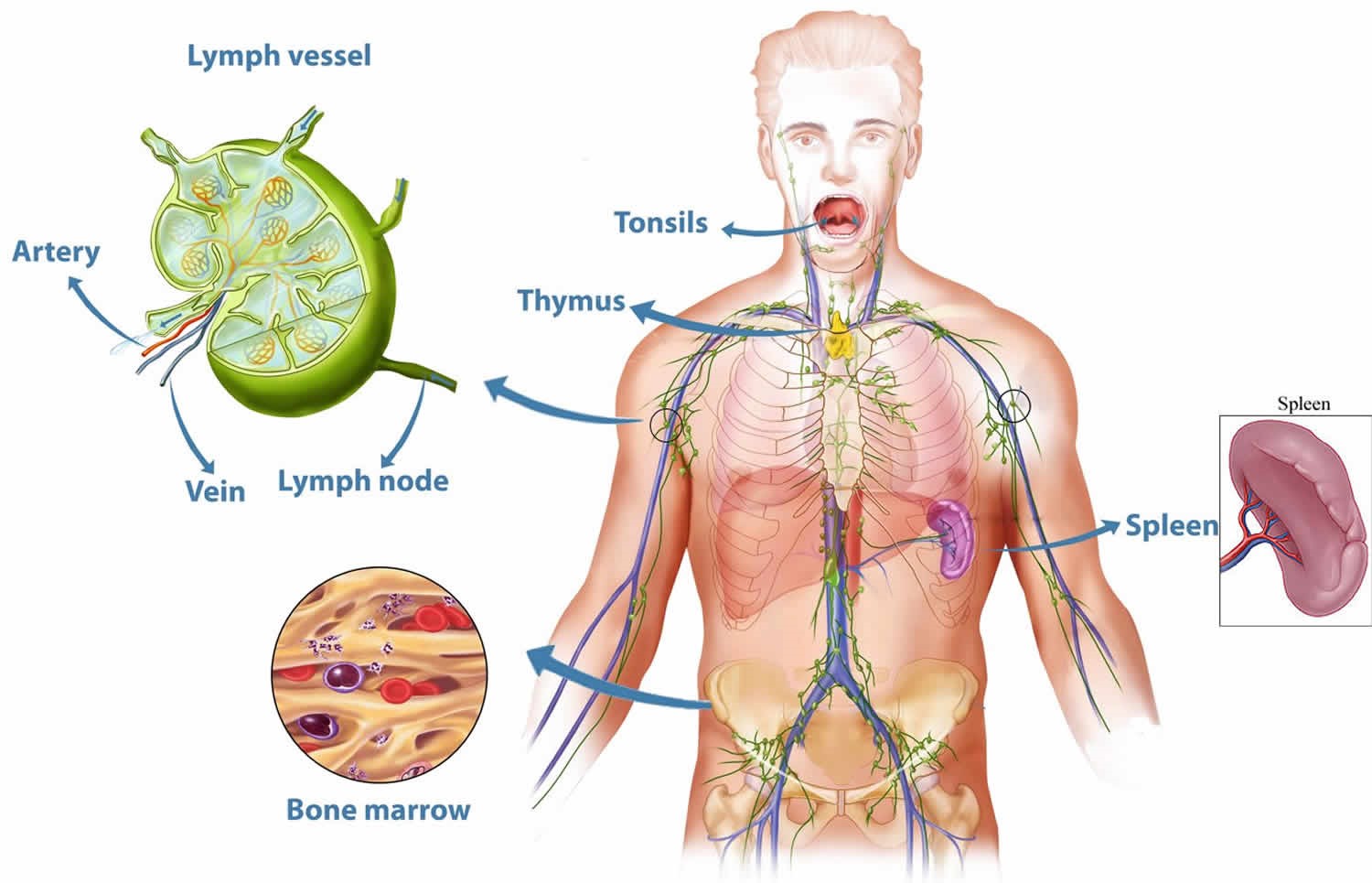
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
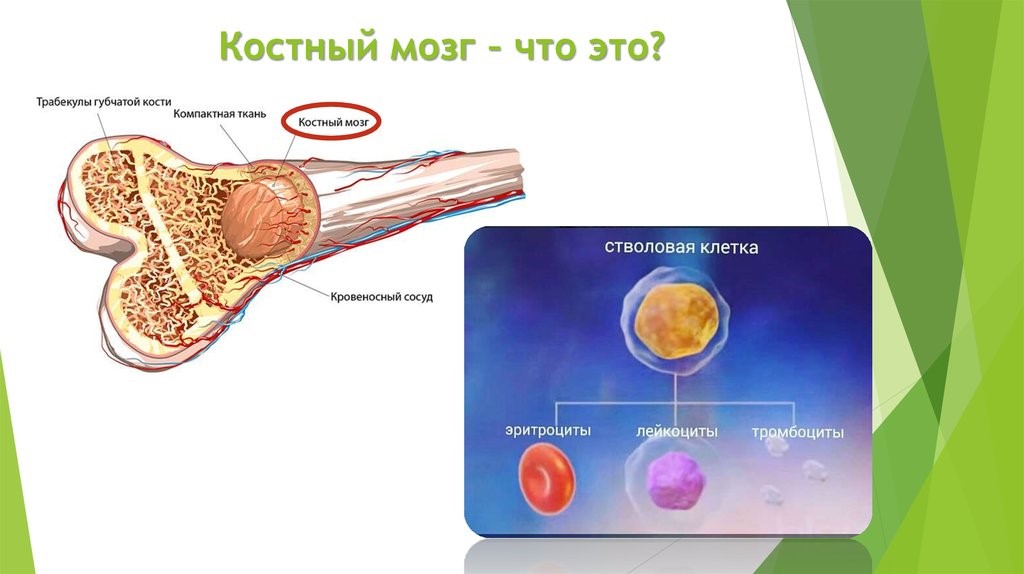
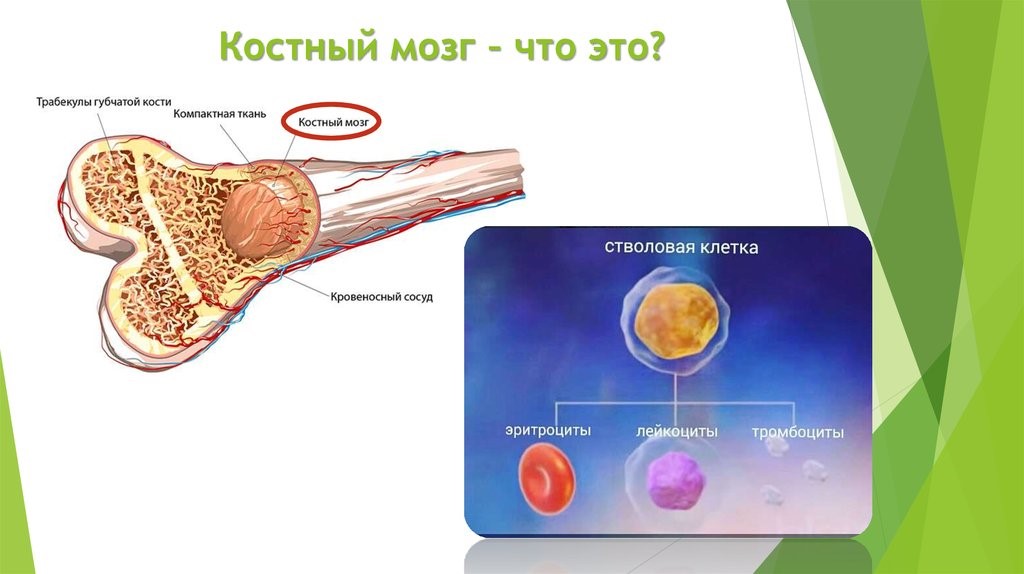
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
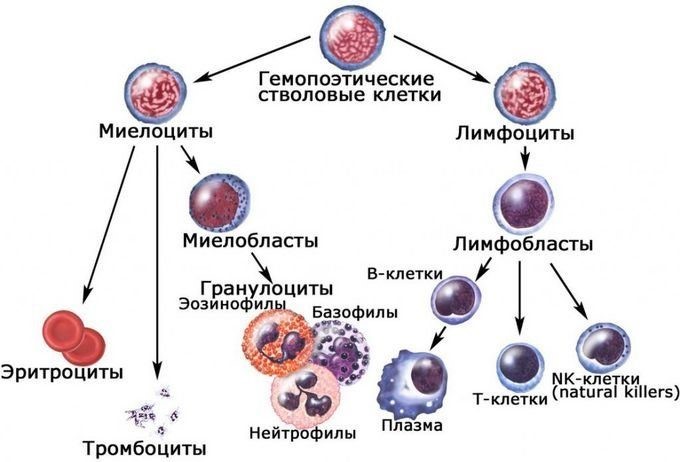
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
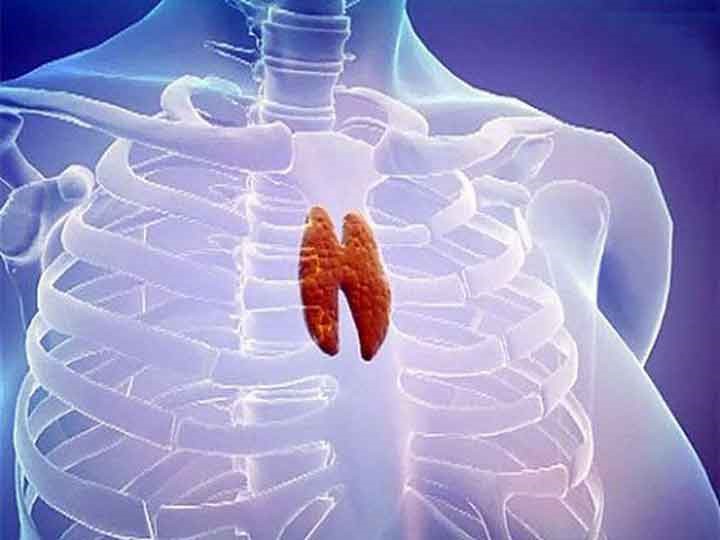
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
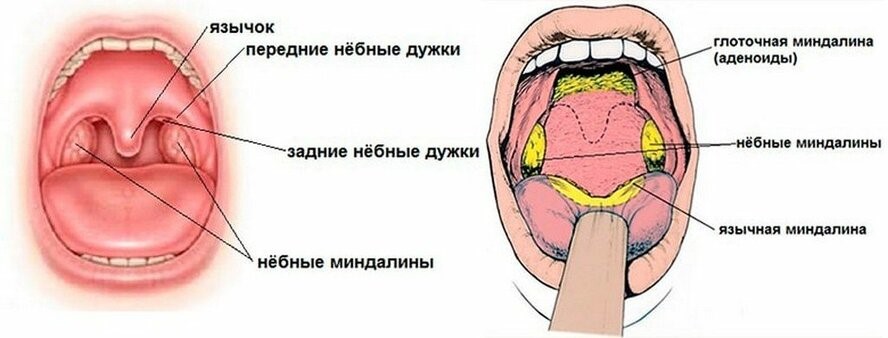
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
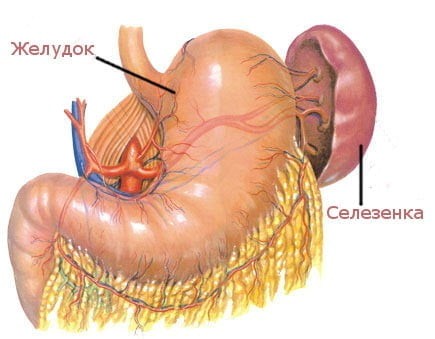
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
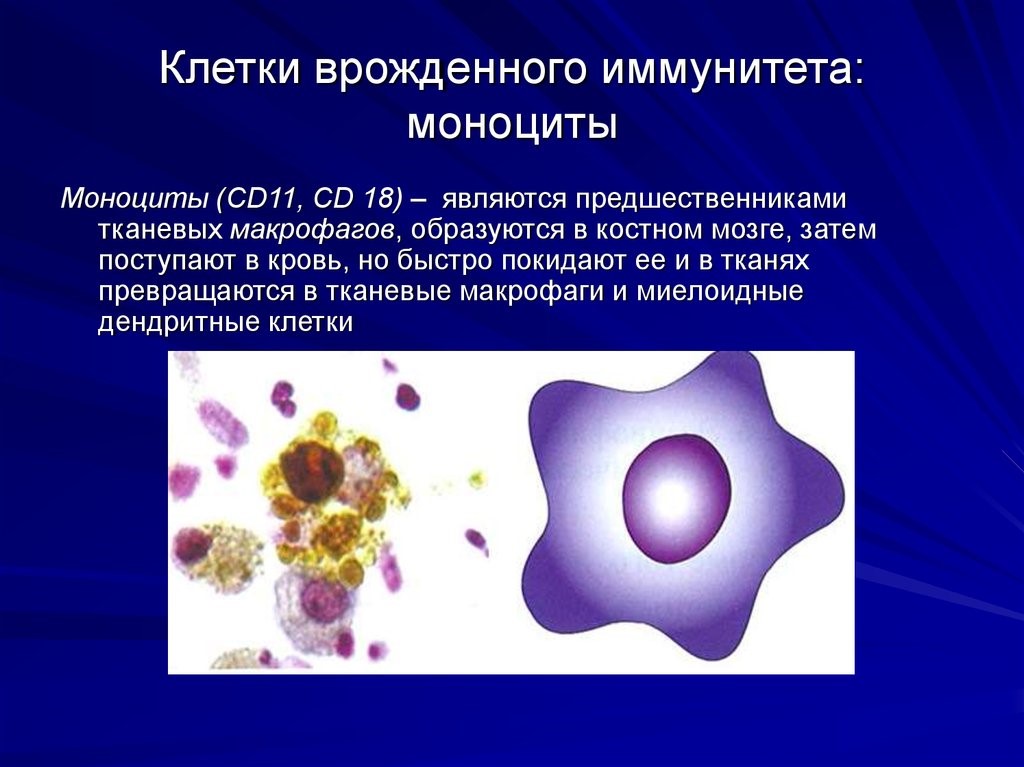
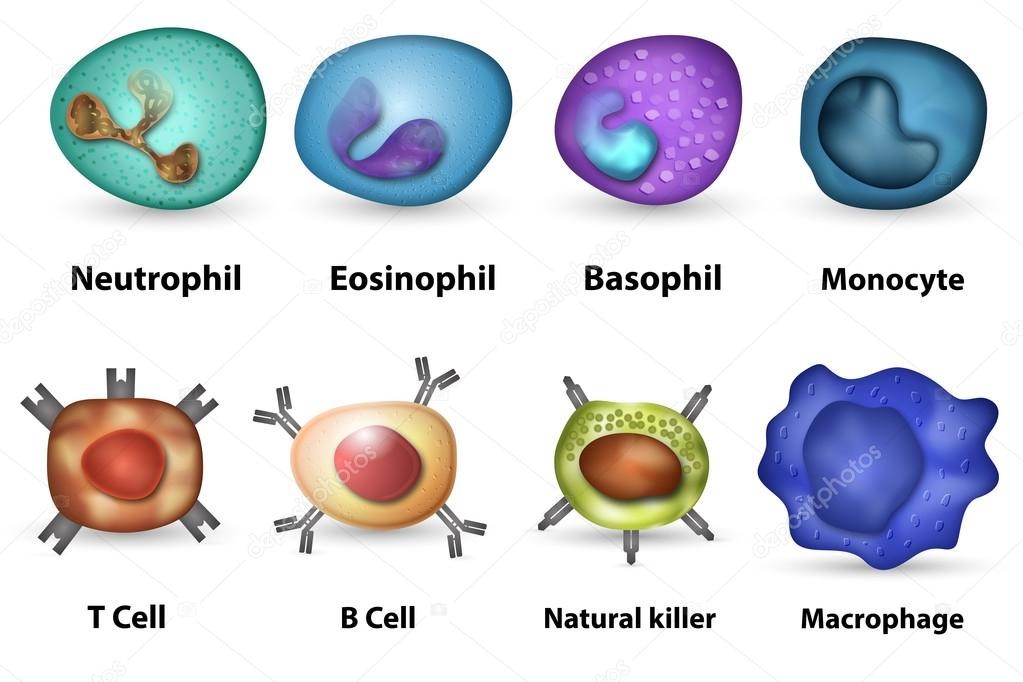
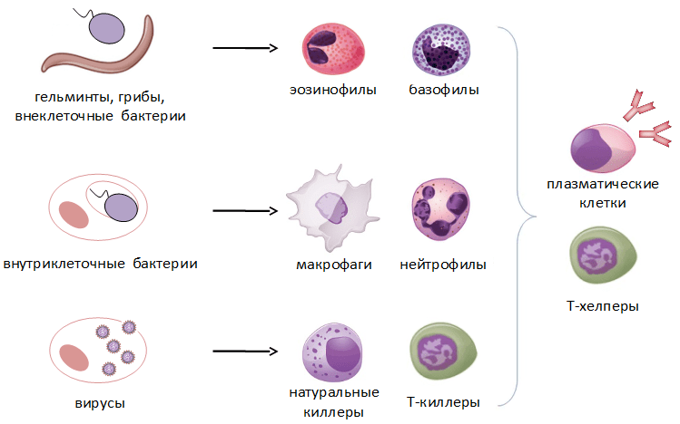
Врожденный иммунитет на клеточном уровне представляют:
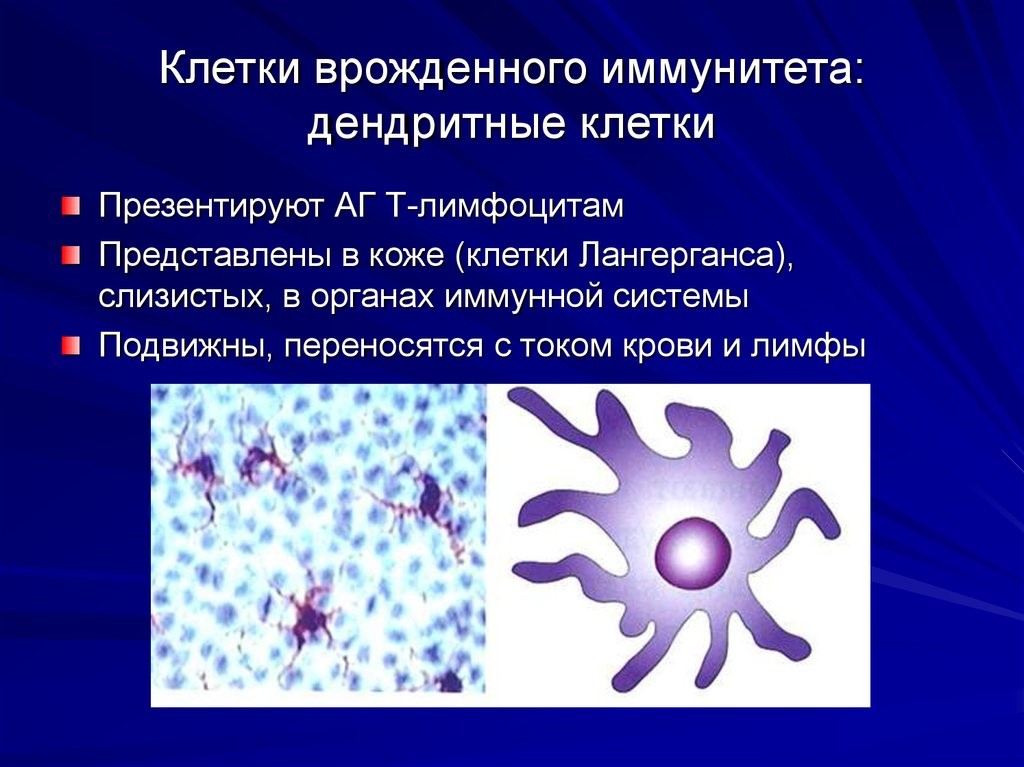
Рис.8. Дендритная клетка и
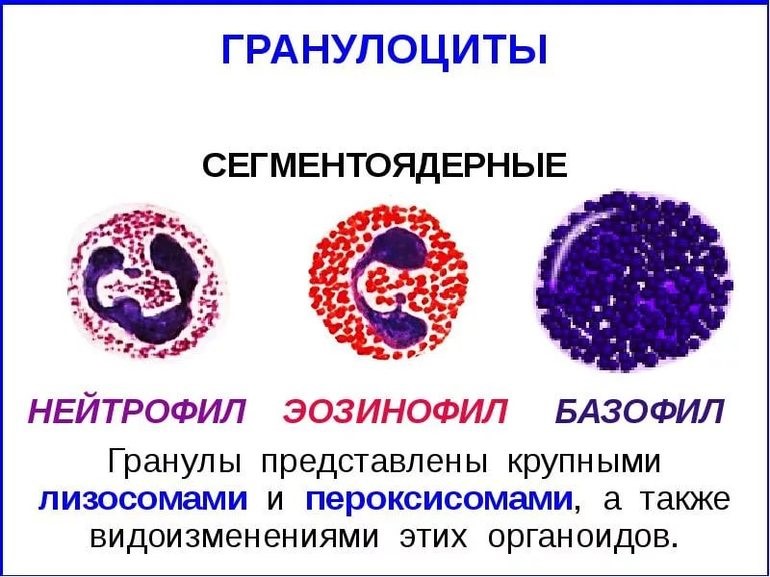
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
Рис.10. Натуральный киллер
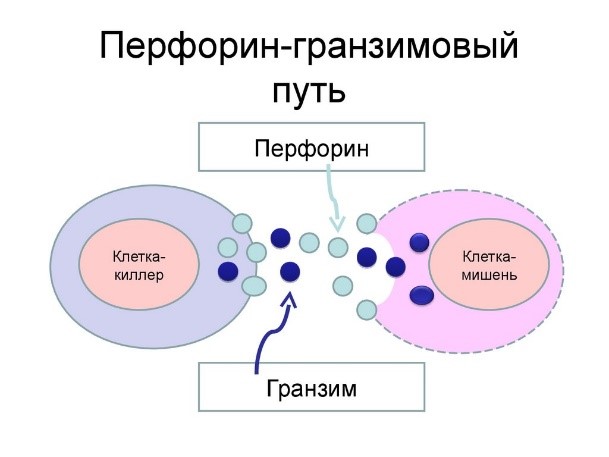
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
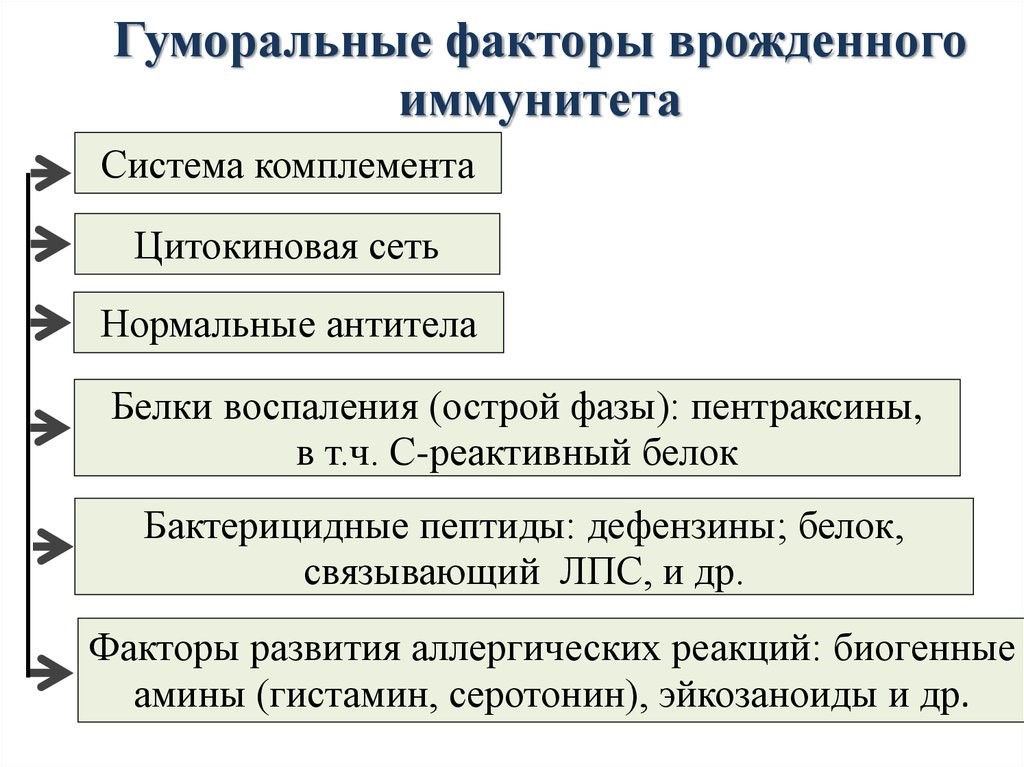
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
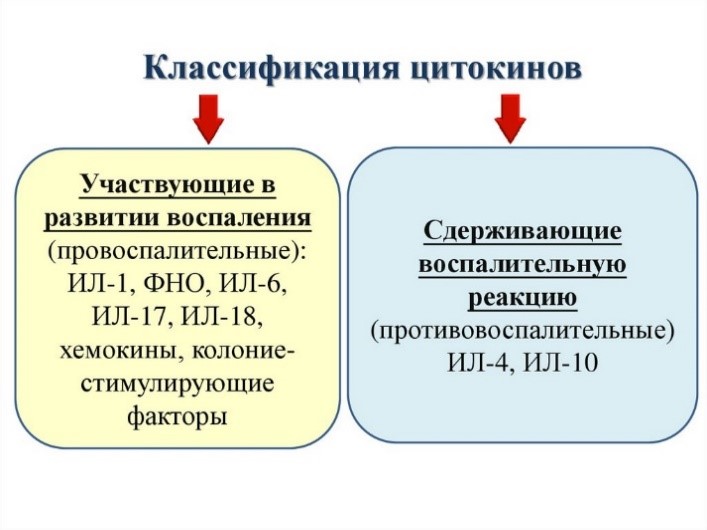
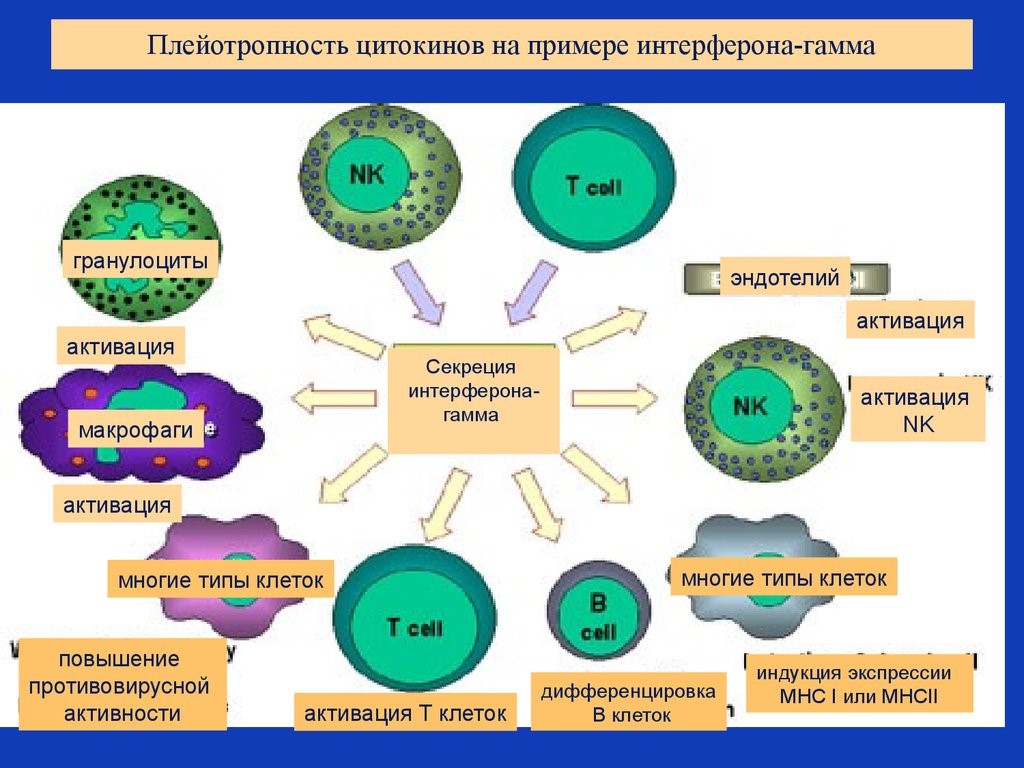
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
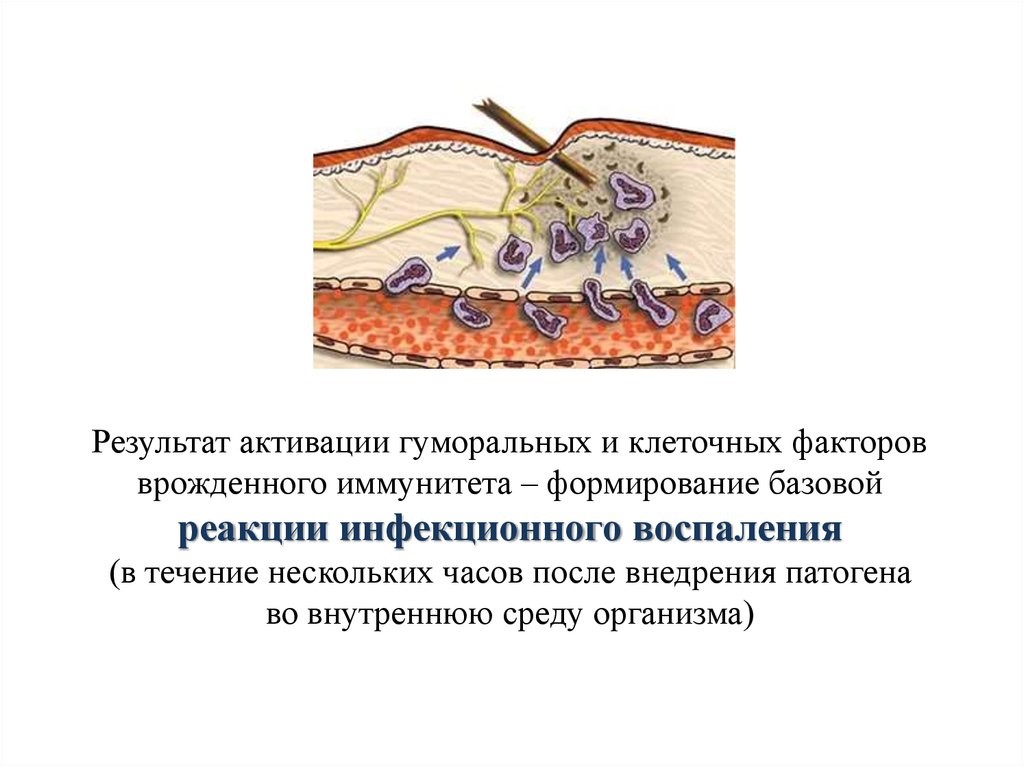
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
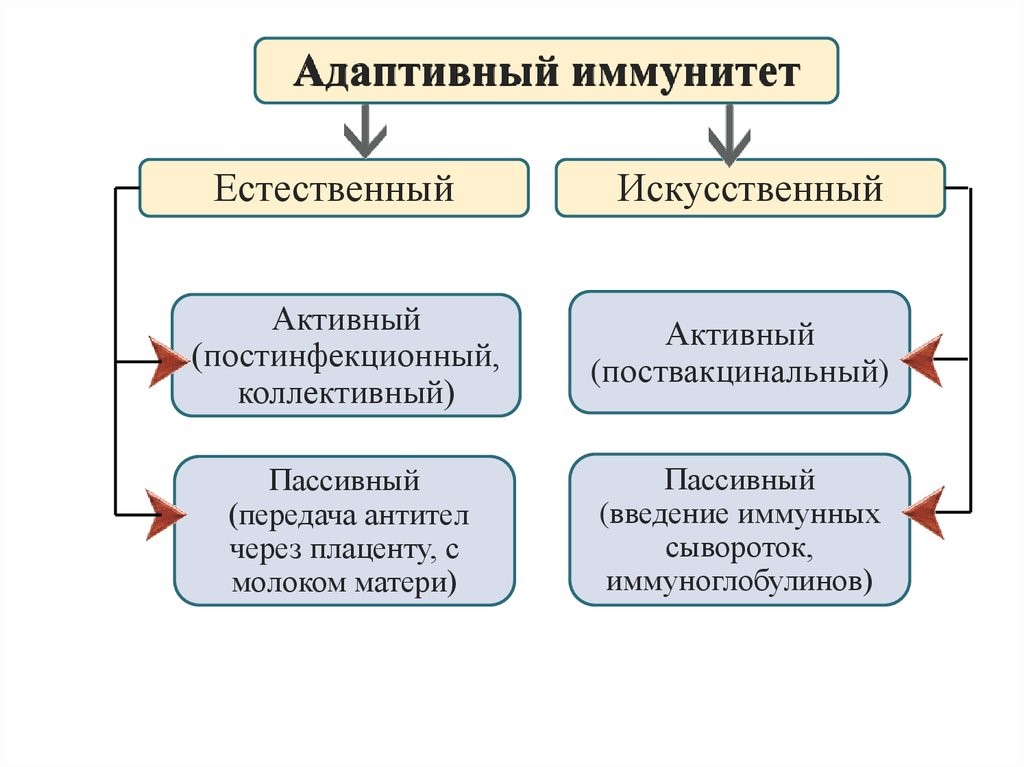
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
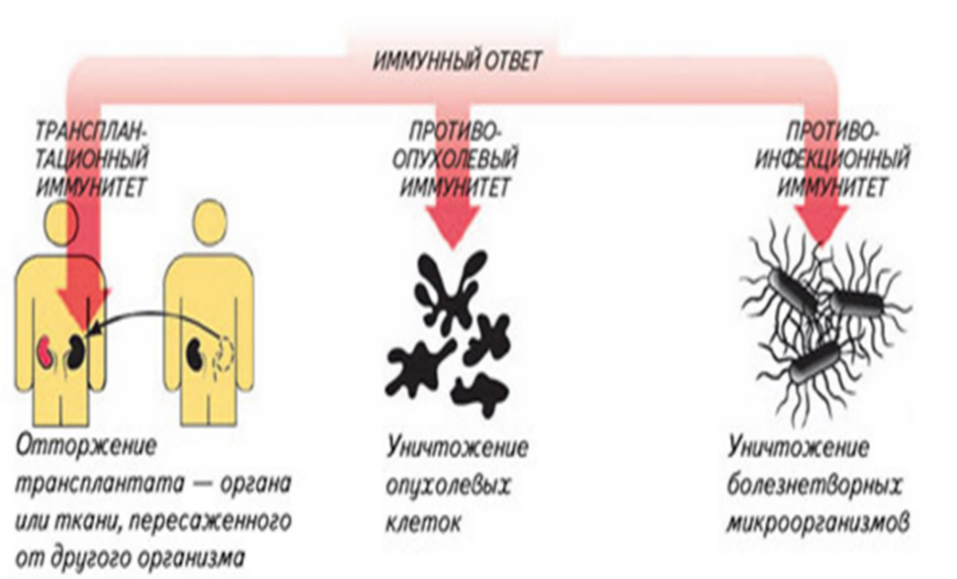
Адаптивный иммунитет основывается на трех главных процессах:
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
Лимфоидная стволовая клетка
CD19, CD72, CD79 и др.
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
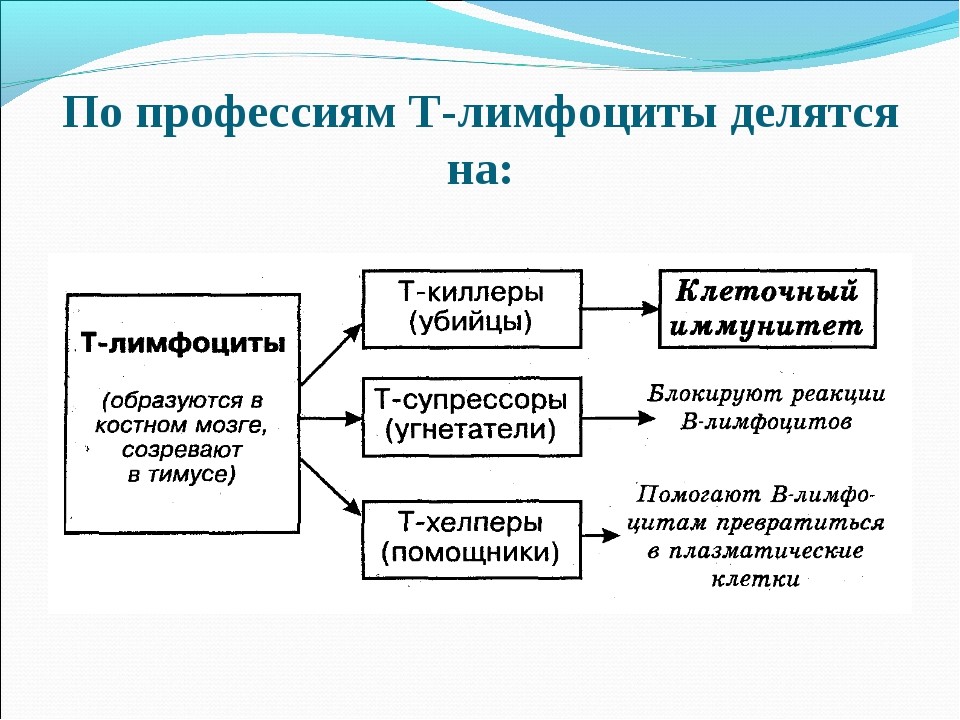
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
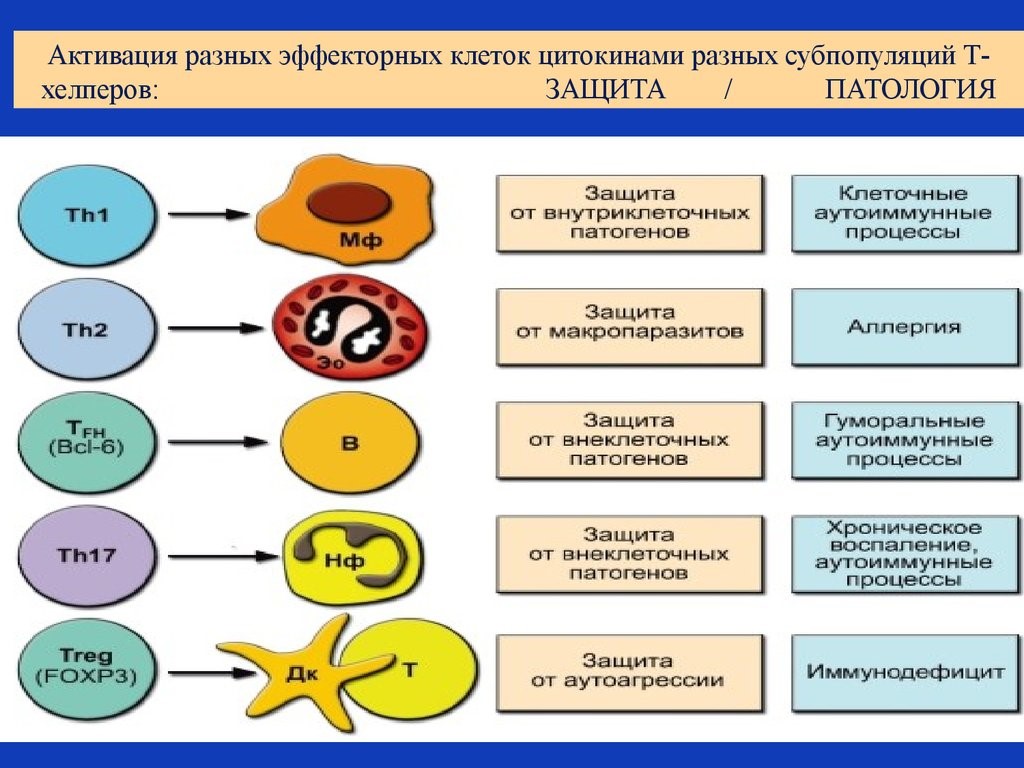
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
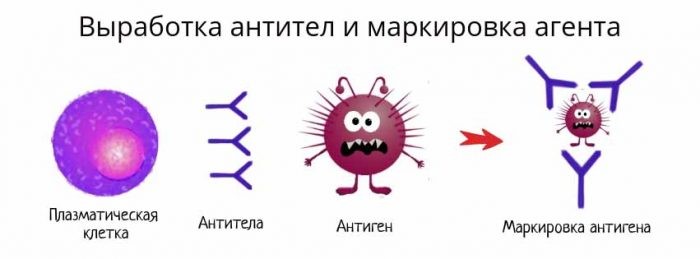
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
Результат молекулярного исследования
Инфицированный или повторно инфицированный пациент
Ранние стадии инфекции. Требуется дополнительное исследование
Инфекция. Требуется дополнительное исследование
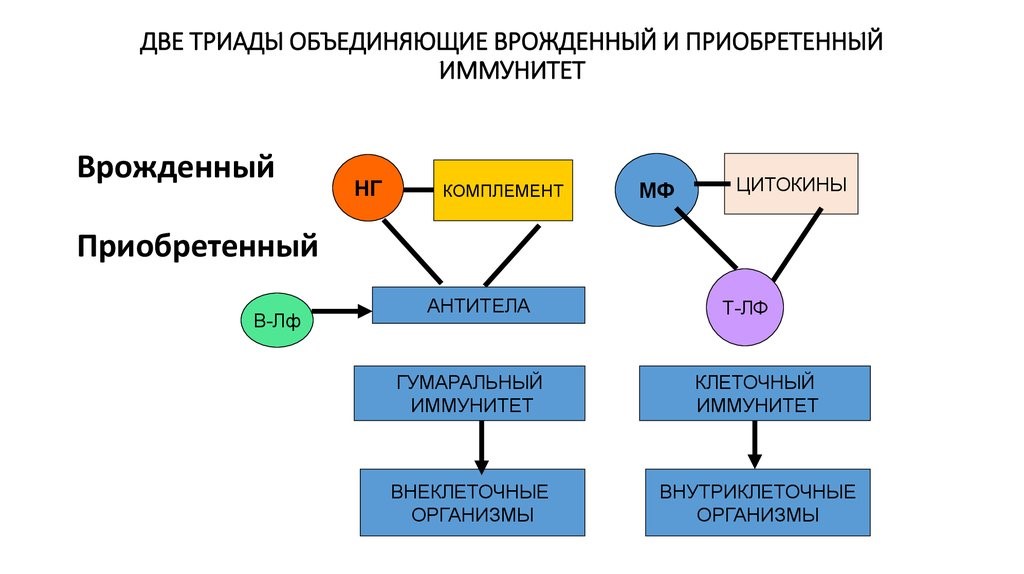
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
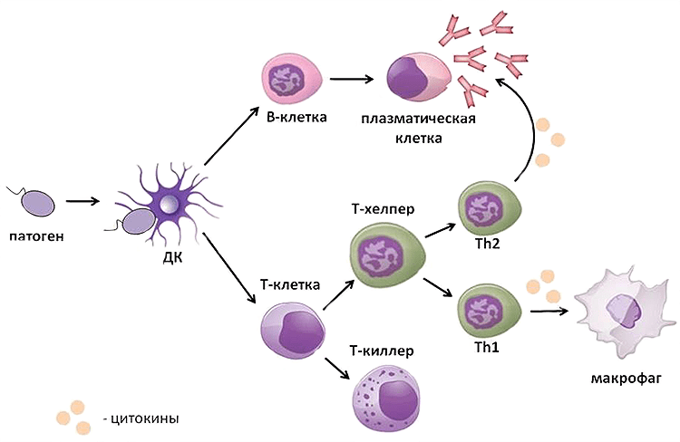
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
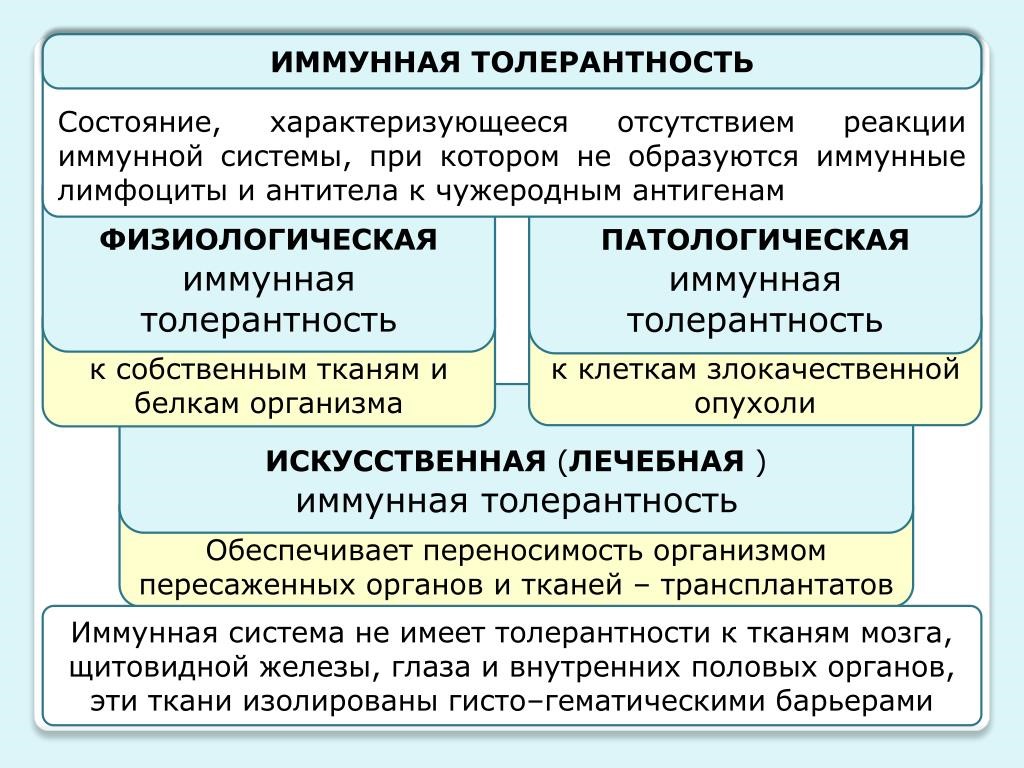
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
Таблица 3. Некоторые первичные иммунодефициты
Частые бактериальные инфекции
Дефицит или полное отсутствие В-лимфоцитов
Антибиотики, пожизненное введение IgG
Частые респираторные инфекции, отиты
Дефекты Т- и В- лимфоцитов
Антибиотики, пожизненное введение IgG
Атаксия-телеангиоэкстазия (синдром Луи-Бар)
Аномалия двигательной функции, слабость мышц, нарушение речи
Дефицит Т- и В- лимфоцитов
ПИД, обусловленные дефектами фагоцитоза
Хроническая гранулёматозная болезнь
Частые пневмонии, гнойные инфекции
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма
ПИД, обусловленные дефектами в системе комплемента
Наследственный ангионевротический отек
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни
Низкая концентрация ингибитора эстеразы С1
Введение концентрата ингибитора эстеразы С1
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
Эффективные методы воздействия на иммунитет:
Спекулятивные методы вокруг иммунитета:
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.