Каталаза в чем содержится больше всего
Каталаза в каких продуктах
Каталаза – фермент, обнаруженный почти во всех живых организмах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
Общие сведения
Фермент каталаза относится к оксидоредуктазам – обширному классу ферментов, которые катализируют перенос электронов от молекулы-восстановителя (донора) к молекуле-окислителю (акцептору).
Оптимальный pH для работы каталазы в человеческом организме около 7, однако, скорость реакции существенно не изменяется при значениях показателя водорода от 6,8 до 7,5. Оптимальное значение рН для других каталаз колеблется от 4 до 11, в зависимости от вида организма. Оптимальная температура также различается, для человека это около 37о С.
Каталаза – один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов.
Структура фермента
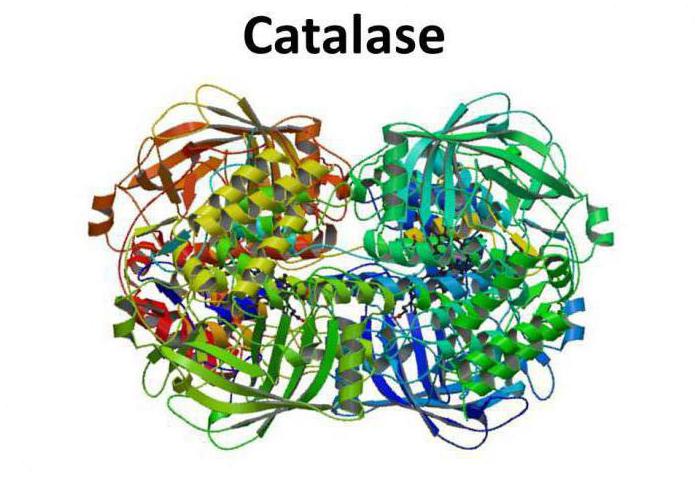
Каталаза представляет собой тетрамер из четырех полипептидных цепей, каждая из которых имеет длину более 500 аминокислот. Фермент имеет в составе четыре группы порфирового гема, благодаря которым и вступает в реакцию с активными формами кислорода. Окисленный гем представляет собой простетическую группу каталазы.
История открытия
Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.
В 1900 году немецкий химик Оскар Лев первым ввел термина «каталаза» для обозначения таинственного вещества, разлагающего перекиси. Он же сумел ответить на вопрос, где содержится фермент каталаза. В результате многочисленных экспериментов Оскар Лев выявил, что данный фермент характерен почти для всех животных и растительных организмов. В живой клетке, как и многие другие ферменты, каталаза содержится в пероксисомах.
В 1937 году впервые удалось кристаллизоваться каталазу из говяжьей печени. В 1938 году была определена молекулярная масса фермента – 250 кДа. В 1981 году ученые получили изображение трехмерной структуры бычьей каталазы.
Катализ перекиси водорода
Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным.
Чтобы предотвратить разрушение клеток и тканей, перекись водорода должна быть быстро превращена в другое, менее опасное для организма вещество. Именно с этой задачей и справляется фермент каталаза – он разлагает молекулу перекиси до двух молекул воды и молекулы кислорода.
Реакция разложения пероксида водорода в живых тканях:
Молекулярный механизм расщепления перекиси водорода ферментом каталазой пока точно не изучен. Предполагается, что реакция проходит в два этапа – на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода.
Благодаря такому действию фермента каталазы на пероксид водорода, наличие этого активного вещества в образцах ткани легко определить. Для этого достаточно добавить к исследуемому образцу небольшое количество перекиси водорода и наблюдать за реакцией. О наличии фермента говорит формирование пузырьков кислорода. Эта реакция хороша тем, что не требует никакого специального оборудования или инструментов – ее можно наблюдать невооруженным глазом.
Стоит заметить, что ион любого тяжелого металла может выступать как неконкурентный ингибитор каталазы. Кроме того, всем известный цианид ведет себя как конкурентный ингибитор каталазы, если в тканях много перекиси водорода. Арсенаты играют роль активаторов.
Применение
Разлагающее действие фермента каталазы на пероксид водорода нашло применение в пищевой промышленности – с помощью этого фермента из молока удаляетсяН2О2 до приготовления сыра. Еще одно применение – специальные пищевые упаковки, которые защищают продукты от окисления. Каталаза также применяется в текстильной промышленности для удаления пероксида водорода из тканей.
Она в небольших количествах используется в гигиене контактных линз. Некоторые дезинфицирующие средства имеют в составе перекись водорода, и каталаза используется для расщепления этого компонента перед повторным использованием линз.
Активность
Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей.
Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда – каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители. Это неожиданное открытие сейчас проверяется исследователями, и, возможно, сыграет роль в разработке препаратов, приостанавливающих поседение волос.
Седые волосы едва ли нравятся хотя бы одному человеку: мы их вырываем, закрашиваем и всячески пытаемся скрыть. Но существуют продукты питания, которые помогают остановить первые признаки старения. О них мы поговорим далее.
Не позднее 50 лет у большинства женщин появляется то, что нельзя отрицать: седина. Некоторые не видят проблем в мерцающем сером, а наслаждаются признаками преклонного возраста. Другие боятся потери цвета и яростно сопротивляются этому.
У каждой женщины со временем появятся седые волосы – у некоторых раньше, у других позже, у одних больше, у вторых меньше. Но процесс, пока серый цвет не покроет всю голову, может, по крайней мере, сдерживаться. Например, с помощью продуктов, которые мы едим. Далее ты узнаешь, какие продукты помогают бороться с сединой.
Продукты с важными питательными веществами
Сначала нужно понять, почему появляются седые волосы. Образуемый организмом естественный краситель меланин создает индивидуальный цвет волос каждого человека.
Со временем производство меланина замедляется, поэтому вместо цветового пигмента мы видим серый или белый цвет. Если волос однажды потерял свой цвет, он уже никогда его не восстановит. Здесь помогут только краски для волос.
Наши волосяные клетки определяются гормонами и генетикой, но к важным факторам также относятся жизненные обстоятельства, болезни, стресс, агрессивные уходовые продукты или определенные медикаменты. Все они способны повлиять на производство меланина. Регулярное потребление никотина приводит к быстро сокращающейся выработке меланина: курильщики могут рассчитывать на раннее появление седины.
Животные белки, фрукты и бобовые
Но принимаемые извне витамины и питательные вещества влияют на цвет волос. Вот где в игру вступают здоровые продукты. Потому что так называемый меланзитен в корне волоса, то есть клетки, вырабатывающие меланин, поддаются влиянию и могут активно поддерживаться.
Медь является настоящим чудо-оружием для корней волос и поддерживает производство меланина. Особенно много меди содержится в бананах, орехах, бобовых, таких как нут и чечевица, а также в какао. Эти продукты служат омоложению волос.
Не менее важным является белок креатин, он укрепляет корни волос. Он содержится в основном в таких продуктах животного происхождения, как рыба и яйца. Эти продукты также помогают против поседения волос. Многие эксперты рекомендуют ограничить употребление никотина, кофе и алкоголя.
Домашнее средство: луковый сок
Несколько необычное домашнее средство от седых волос: настойка лукового сока. Сок не пьют, а наносят на волосы, он призван стимулировать выработку каталазы. Как и меланин, каталаза важна для цвета волос. Фермент расщепляет перекись водорода в корне волоса и предотвращает появление седины.
Массаж головы как средство от седины
Эксперты рекомендуют объединить правильное питание с регулярным массажем кожи головы. Кожа, хорошо снабжаемая кровью, легче напитывает корни волос необходимыми для выработки меланина веществами.
Не забудьте лайкнуть и поделиться, если понравилось, а также подписаться на канал, чтобы быть в курсе новостей с missfit.ru
Что такое каталаза, полезные свойства каталазы, противопоказания каталазы
Меня раньше очень долго мучал вопрос: дают ли банки ипотеку инвалидам? В январе 2020 года я взял ипотечный кредит на 20 лет
Телёнок по двору скачет, Он неуклюж и смешон, Солнце улыбку не прячет, Льётся со всех сторон… …………………………………….
Рано утром встанет зорька, Краски бросит на луга, Разольётся по пригоркам, Заискрятся облака…
Каталаза представляет собой антиоксидантный фермент, который, подобно супероксиддисмутазе (SOD) и глутатионпероксидазе, образуется естественным образом внутри организма. Это помогает организму превращать перекись водорода в воду и кислород, тем самым предотвращая образование пузырьков углекислого газа в крови. Каталаза также использует перекись водорода для разрушения потенциально вредных токсинов в организме, включая спирт, фенол и формальдегид.
Польза каталазы для организма
Каталаза работает в тесном контакте с супероксиддисмутазой для предотвращения повреждения свободных радикалов организмом. SOD превращает опасный супероксидный радикал в пероксид водорода, который каталаза превращается в безвредную воду и кислород. Каталазы являются одними из наиболее эффективных ферментов, обнаруженных в клетках; каждая молекула каталазы может превращать миллионы молекул пероксида водорода каждую секунду.
Перекись водорода представляет собой природный, но разрушающий отходы всех кислородзависимых организмов. Он вырабатывается в организме человека, когда жирные кислоты превращаются в энергию, и когда белые кровяные клетки атакуют и убивают бактерии. Каталаза, которая находится в пероксосоме клетки, не позволяет этому природному перекисью водорода вредить клетке во время этих процессов. Это также помогает предотвратить превращение перекиси водорода в гидроксильные радикалы, потенциально опасные молекулы, которые могут атаковать и даже мутировать ДНК.
Было высказано предположение, что одним из основных причин возникновения возраст клеток является повреждение ДНК, вызванное свободными радикалами и окислителями, такими как перекись водорода, и что повышение уровней естественных свободнорадикальных истребителей организма – SOD, каталазы и глутатионпероксидазы – могли бы как улучшить здоровье человека, так и увеличить продолжительность жизни людей. Доктор Мартин Чалфи и его коллеги из Колумбийского университета обнаружили новые доказательства, подтверждающие эту теорию, когда они недавно обнаружили и изолировали ген у нематод, который использует каталазу для нейтрализации свободных радикалов и защиты клеток от окислительного повреждения. Мутирование этого гена для включения и выключения производства каталазы увеличивало и уменьшало продолжительность жизни нематоды соответственно. Возможно, что старение человека, как и у нематоды, является результатом воздействия свободных радикалов, а не времени.
Каталаза, супероксиддисмутаза, метионинредуктаза и глутатионпероксидаза производятся в организме. Однако, если вы хотите попытаться бороться с последствиями старения или предотвратить серьезную болезнь, вы можете захотеть дополнить эти ферменты.
Устные дополнения доступны для SOD, каталазы и глутатионпероксидазы; однако эти вещества могут перевариваться в кишечнике до того, как они когда-либо достигнут телесных тканей. Предоставление организму дополнительных количеств строительных блоков, необходимых для создания этих природных антиоксидантов, таких как марганец, цинк, медь и селен, может быть более эффективным способом увеличения их присутствия в организме.
Каталаза в чем содержится больше всего
Изучение влияния кондитерских продуктов питания на активность каталазы
Автор работы награжден дипломом победителя II степени
Наиболее важными соединениями, которые входят в состав живых организмов, являются белки (протеиды). Белки служат основой всего живого на нашей планете.
Эти органические вещества играют огромную биологическую роль, являясь тем основным веществом, из которого построены клетки животного организма. Белки участвуют в важнейших процессах живого организма — обмене веществ, размножении, росте организма, работе мышц, желез [1].
В основе всех жизненных процессов лежат тысячи химических реакций. Долгая жизнь, молодость человеческого тела, силы- с возрастом всё это ощущается меньше и меньше. Это происходит потому, что количество ферментов в нашем организме изменяется, вследствие этого идет нарушение важных для организма процессов [14]. Ферменты позволяют целенаправленно выделять вещества из смеси сотен различных соединений и определять их количество [7]. Во взаимодействии с ферментами становятся активными витамины, гормоны и микроэлементы[17].
Ферменты влияют на скорость превращения различных веществ. Но и на ферменты влияют некоторые вещества, резко изменяя их активность. Вещества, которые повышают активность ферментов, активизируют их, называются активаторами, а угнетающие их — ингибиторами [7].
При производстве продуктов питания в настоящее время используются разнообразные пищевые добавки: красители, антиокислители, консерванты, стабилизаторы, ароматизаторы, эмульгаторы.
Гипотеза – кондитерские продукты питания, содержащие пищевые добавки, могут угнетать активность каталазы.
Объект исследования: фермент каталаза.
Предмет исследования: ферментативная активность.
Цель: изучение влияния на активность каталазы кондитерских продуктов питания, содержащих пищевые добавки.
1. Изучить по данным литературы материал о ферменте каталаза и пищевых добавках, используемых в производстве продуктов питания.
2. Провести исследования активности каталазы в присутствии кондитерских продуктов питания, содержащих пищевые добавки.
3. Обработать результаты статистически.
Важнейшим свойством ферментов является преимущественное ускорение одной из нескольких теоретически возможных реакций. Это позволяет субстратам выбрать наиболее выгодные для организма цепочки превращений из целого ряда возможных путей.
В зависимости от условий ферменты способны катализировать как прямую, так и обратную реакции [10, 12].
Другое свойство ферментов — высокая чувствительность к изменениям температуры. Для большинства из них температура свыше 70°С приводит к денатурации и потере активности. При температурах, близких к О°С, скорость ферментативных реакций замедляется до минимума. Это свойство широко используется в различных отраслях народного хозяйства, особенно в сельском хозяйстве и медицине. Для большинства же ферментов температурный оптимум близок к 35—45 °С.
Одним из важнейших свойств белков-ферментов является их чувствительность к реакции среды, концентрации водородных ионов или гидроксид-ионов. Ферменты активны только в узком интервале кислотности или щелочности среды (pH) [10, 12].
1.2. Классификация ферментов
Все ферменты разделены на шесть основных классов в соответствии со специфичностью их действия [9].
1. Оксидоредуктазы катализируют восстановительные и окислительные реакции.
2. Трансферазы осуществляют перенос той или иной химической группы от одного субстрата к другому.
3. Гидролазы катализируют гидролитическое расщепление химических связей субстратов.
4. Лиазы отщепляют химические группы с образованием двойных связей или, напротив, присоединяют определённые химические группы к двойным связям.
5. Изомеразы катализируют изменения в пределах молекулы субстрата.
6. Лигазы катализируют соединения молекул субстрата с использованием высокоэнергетических соединений
1.3. Работа фермента
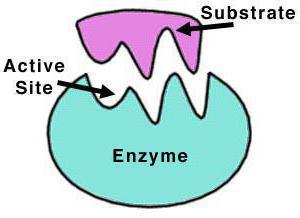
Ферменты представляют собой большие молекулы, тогда как размеры молекул веществ (субстратов), реагирующих под влиянием ферментов, обычно в сотни и тысячи раз меньше. Такое соотношение размеров показывает, что фермент взаимодействует с субстратом каким-то небольшим участком своей поверхности — так называемым активным центром. Этот участок имеет определенную геометрическую форму, которая соответствует молекуле субстрата, как ключ замку. Когда «ключ вставляется в замок», образуется комплекс субстрата с ферментом. В таком комплексе молекула субстрата более реакционноспособна, чем в свободном состоянии. Энергия, которую необходимо затратить для осуществления химической реакции, понижается, и реакция проходит быстрее. Специфичность фермента определяется тем, насколько поверхность его активного центра соответствует поверхности субстрата [2]. Ферментативные реакции протекают с очень высокой скоростью, практически со 100%-ным выходом, без существенных затрат энергии и без образования побочных продуктов [3].
1.4. Фермент каталаза
Каталаза — это фермент, являющийся катализатором в реакции разложения перекиси водорода, при которой образуются вода и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2Н2О. Биологическое значение каталазы заключается именно в разложении перекиси водорода, которая образуется в клетках при воздействии ряда флавопротеиновых оксидаз, чем обеспечивается действенная защита клеточных структур от разрушения, которое осуществляет перекись водорода [13,18]. Перекись водорода является сильным окислителем и в крови может вызывать гемолиз эритроцитов [20].
Фермент каталаза широко распространен в тканях животных и растений и в микроорганизмах. Содержание каталазы в печени и эритроцитах млекопитающих составляет 0,1—0,2%, в отдельных штаммах микроорганизмов — до 5% сухого веса. Фермент полностью отсутствует у некоторых анаэробных микроорганизмов. В растениях фермент присутствует в небольших количествах [19].
Каталаза, относящаяся к классу оксидоредуктаз, содержится в животных и растительных тканях и включает железо в составе геминовой простетической группы. Фермент проявляет высокую активность: одна молекула каталазы разлагает до 5 млн. молекул перекиси водорода в минуту при 0 °С.
Максимальная активность фермента обнаруживается в интервале от 0 ° до 10 °С. Оптимальное значение pH действия лежит в пределах 6,0-8,0 единиц [5].
Активность каталазы ингибируется цианидом, фторидом, сульфидом, ацетатом. Каталаза быстро инактивируется в растворе при pH больше 10,0 и меньше 4,0 и в присутствии высоких концентраций мочевины или других вызывающих разрыв водородных связей агентов. Инактивация фермента связана с образованием каталитически неактивных субъединиц [19].
1.5. Пищевые добавки
Пищевые добавки применяют пищевики всех стран мира. Термином «пищевые добавки» обозначают природные, идентичные природным или синтетические химические соединения, которые специально добавляют в пищевой продукт по ходу технологического процесса для достижения определенного эффекта [11].
Одни добавки способствуют сохранению продукта (консерванты), другие придают аромат (ароматизаторы), третьи нужную окраску (красители). Антиокислители защищают от окисления, стабилизаторы сохраняют заданную консистенцию [6].
На пищевых товарах такие добавки маркируются буквой Е и обозначаются трехзначным числом. [Приложение 1] [15].
Пищевые добавки являются небезопасными для здоровья, некоторые являются аллергенами, другие вызывают заболевания желудочно-кишечного тракта, печени, почек, желудка. Есть добавки, вызывающие злокачественные опухоли, поэтому некоторые из них являются запрещенными к применению Роспотребнадзором Минздрава РФ:
-красители Е121, Е123, Е128, Красный 2G (red 2G), Е173;
— консерванты Е216, Е217, Е240;
— улучшители муки и хлеба Е924а и Е 924b [Приложение 2] [11].
Если пищевые добавки способствуют заболеванию разных органов человека, возможно одной из причин этого является влияние пищевых добавок на работу ферментов.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Объекты исследования.
Для исследования активности каталазы в магазинах с. Частые купили продукты, содержащие различные пищевые добавки [Приложение 3].
2.2. Изучение активности каталазы
Активность каталазы измеряется манометрическим методом, который основан на измерении объема кислорода, выделившегося при воздействии фермента на субстрат.
2.2.1 Методика исследования
2.2.1.1. Методика получения ферментной вытяжки каталазы из клубней картофеля.
Приготовить навеску 1г очищенного клубня картофеля и тщательно растереть в охлажденной льдом ступке, добавить 0,3г мела и 5-10 мл дистиллированной охлажденной воды. Затем полученный гомогенат ткани разбавить охлажденной дистиллированной водой из расчета 30-50 мл на 1г картофеля. Полученный раствор (ферментную вытяжку) после отстаивания слить для отделения от растительных остатков, измерить объем в мерной посуде и хранить в стеклянном стаканчике или колбе на холоде[5].
2.2.1.2. Приготовление раствора исследуемого пищевого продукта.
Пищевой продукт растворить в 50 мл дистиллированной воды (рис. 1).
Рис. 1. Приготовление раствора исследуемого пищевого продукта
2.2.1.3. Методика измерения активности каталазы.
Для определения активности каталазы пользуются прибором, который состоит из каталазника 1, бюретки 5 на 50 мл и стеклянной груши 4 или воронки, соединенных каучуковыми трубками и стеклянным тройником 2. Каучуковая трубка на свободном конце тройника снабжена зажимом 3. В штативе закреплена бюретка и стеклянная груша 4. Их заполняют дистиллированной водой до половины объема (рис. 2,3).
Рис. 2. Прибор для определения активности каталазы
Рис. 3. Прибор для определения активности каталазы
В одно колено каталазника поместить 3 мл ферментной вытяжки, а в другое 3 мл раствора перекиси водорода (субстрата). Присоединить каталазник к прибору, установить нулевую точку жидкости в бюретке. Быстро слить и перемешать растворы в одном из колен каталазника и через определенное время (через каждую минуту или 5 мин) отмечать объем кислорода, который выделяется в процессе ферментативной реакции. Активность фермента выразить в объеме кислорода (мл), выделившегося за 1 мин (5 мин), в расчете на 1г сырой растительной ткани по формуле:
Объем О2 * общий объем ферментативной вытяжки (мл)
Время (мин) * объем ферментативной пробы (3мл)
Добавить в одно из колен каталазника 1мл того или иного ингибитора непосредственно перед перемешиванием перечисленных выше растворов (опытные пробы)[5].
2.2.3. Изучение активности каталазы в присутствии кондитерских продуктов питания, содержащих пищевые добавки.
2.2.3.1. Получение ферментной вытяжки каталазы из клубней картофеля.
Взвешивала 1г очищенного клубня картофеля (рис.4). Тщательно растирала навеску в охлажденной снегом ступке (рис. 5).
Рис. 4. Взвешивание клубня картофеля Рис. 5. Измельчение навески клубня картофеля
Добавляла 0,3г мела и 10 мл дистиллированной охлажденной воды (рис. 6,7).
Рис. 6. Взвешивание мела Рис. 7. Добавление дистиллированной воды
Затем полученный гомогенат ткани разбавляла 50мл охлажденной дистиллированной воды. Полученный раствор (ферментную вытяжку) после
отстаивания сливала для отделения от растительных остатков, измеряла объём и хранила в стеклянном кристаллизаторе в снегу (рис. 8,9).
Рис. 8. Измерение объема ферментной вытяжки Рис. 9. Хранение ферментной вытяжки
2.2.3.2. Изучение активности каталазы в присутствии кондитерских продуктов питания, содержащих пищевые добавки.
Для исследования собрала прибор (рис. 3). В одно колено каталазника пипеткой наливала 3 мл ферментной вытяжки (рис.10).
Рис. 10. Отбор ферментативной вытяжки каталазы из клубней картофеля
В другое колено каталазника наливала 3 мл раствора перекиси водорода (субстрата) (рис. 11).
Рис. 11. Отбор перекиси водорода для исследований
Добавляла в контрольный 1мл дистиллированной воды, а в опытные растворы продуктов питания, содержащих пищевые добавки (рис. 12).
Рис. 12. Добавление к перекиси водорода раствора пищевого продукта
Присоединяла каталазник к прибору, устанавливала нулевую точку жидкости в бюретке. Быстро сливала и перемешивала растворы в одном из колен каталазника. Через каждые 5 мин в течение 20 мин отмечала объем кислорода, который выделяется в процессе ферментативной реакции (рис. 13, 14, 15).
Рис. 13. Подготовленный к исследованию каталазник
Рис.14. Присоединение каталазника к прибору
Рис. 15. Регистрация данных
Активность фермента рассчитала по формуле:
Объем О2 * общий объем ферментной вытяжки (мл)
Время (мин) * объем ферментной пробы (3мл)
Исследована активность каталазы в присутствии 13 кондитерских продуктов питания и сахарозы. Данные приведены в таблице 1, 2.
Активность каталазы в присутствии кондитерских продуктов питания