что делают в реанимационном отделении
Реанимация: как все устроено
После того как вопрос о посещении родственниками реанимационных отделений был задан в ходе прямой линии с Президентом Российской Федерации, его обсуждение продолжилось и в СМИ, и в социальных сетях. Как всегда, дискутирующие поделились на два противоположных лагеря, слегка позабыв, что обсуждают очень сложный и деликатный вопрос.
Родственники больных нередко считают, что у них должен быть доступ в палаты интенсивной терапии круглосуточно и они могут диктовать свои условия или вмешиваться в работу медицинского персонала. Это вызывает вполне справедливое неприятие у медиков. Чтобы понять, как прийти к решению, которое устроило бы всех, стоит вспомнить, как вообще работает отделение реанимации и интенсивной терапии.
Наиболее сбалансированное реанимационное отделение состоит из 12 коек – это, как правило, две палаты по шесть человек.
Почему так? Это коррелирует с рекомендованным штатным расписанием, утвержденным приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 919 «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю “анестезиология и реаниматология”». Согласно ему на шесть реанимационных больных должен быть организован один круглосуточный пост врача. И эта практика характерна не только для России, она применяется во многих странах мира.
Тяжелых больных аккумулируют в одном месте, чтобы у медиков была возможность постоянно наблюдать за ними и в кратчайшие сроки приступить к оказанию неотложной помощи.
Ведь если каждого больного поместить в отдельную палату, даже наличие высокотехнологичного медицинского оборудования, видеокамер и других приспособлений не заменит личного присутствия врача. И уж точно не ускорит возможность выполнения неотложных процедур.
Вторая особенность реанимационного отделения, и особенно хирургического, – отсутствие разделения больных по полу и возрасту. В одной палате могут находиться и мужчины, и женщины, и молодые, и пожилые. Конечно, мы стараемся создать пациентам, находящимся в сознании, определенную зону комфорта – например, отгораживаем кровати ширмами. Но тут появляется очень серьезный вопрос: даже если один пациент хочет видеть своих родственников, как к этому отнесутся его соседи по палате? Все ли, находясь в таком тяжелом состоянии, готовы к визиту посторонних людей?
Кроме того, не стоит забывать, что работа врача анестезиолога-реаниматолога состоит не из самых эстетичных моментов. Больной находится в состоянии, в котором он не контролирует себя, у него может случиться, например, непроизвольное мочеиспускание. Все ли родственники больных готовы за этим наблюдать круглые сутки? Мне кажется, нет.
Родственникам, как правило, достаточно увидеть своего близкого, который подключен к системам жизнеобеспечения. Он вымыт, выбрит, от него нормально пахнет, рядом с ним профессиональные медики, современная аппаратура. Для спокойствия родных необходима прежде всего уверенность в том, что человек не брошен, что им занимаются, – для этого достаточно 5–7 минут, а иногда даже одного взгляда.
Конечно, бывают разные ситуации. Но если врачам удается выстроить с родственниками пациентов нормальные человеческие отношения, все решаемо.
Например, может возникнуть ситуация, при которой посетителя просят срочно покинуть реанимационный зал. Позже можно выйти и объяснить, что больному было плохо, ему нужно было провести реанимационные мероприятия – и это та серьезная причина, по которой родственника попросили выйти. Если человек не в состоянии алкогольного или наркотического опьянения, если с ним можно нормально общаться, то он все понимает и начинает чувствовать обстановку в реанимационном отделении.
Есть еще один очень серьезный вопрос: даже если больной в сознании, хочет ли он сам видеть своих родственников?
Это тоже очень деликатный момент. Есть тяжелые травмы, которые могут обезобразить человека, и ему будет просто страшно показаться близким. Насколько для него это будет комфортно психологически?
Поэтому в первую очередь учитываются пожелания пациента. Если пациент говорит «нет», мы деликатно извиняемся перед родственниками и обсуждаем дальнейшие вопросы посещения. Но даже в этом случае родственники хотят знать как можно больше. И очень важный навык, которому нужно научиться сотрудникам реанимационных отделений, – умение рассказать о состоянии больного так, чтобы его понял обычный человек. То есть максимально доступно, избегая сложных медицинских терминов.
Например, можно сказать женщине, что у ее мужа двусторонний гидроторакс. Звучит пугающе, не правда ли? И абсолютно ни о чем ей не скажет. А можно сказать совершенно по-другому: «В силу тяжелого заболевания у вашего мужа собирается жидкость в легких. Мы поставили две трубочки и откачиваем эту жидкость, чтобы ему было легче дышать». Так намного понятнее и звучит более успокаивающе. Это возможность вовлечь родственника в диалог и установить с ним хороший контакт.
Общение с пациентами и их родственниками и даже сообщение им плохих новостей – отдельная тема, ведь в реанимации, к сожалению, пациенты и умирают. У них есть родители, супруги, дети – и печальную новость до близких надо донести так, чтобы не причинить дополнительной боли.
Наши специалисты-реаниматологи должны не только придерживаться концепции сохранения жизни, но и стать более мягкими, милосердными и эмпатичными. Умение находить общий язык с людьми, сопереживать чужому горю – это в реанимационных отделениях зачастую намного важнее, чем неограниченное время посещения.
Что делают в реанимационном отделении
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
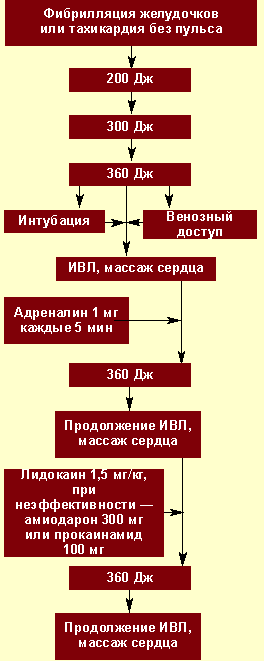 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара
За дверями реанимации: «там идёт борьба за жизнь»
Работа отделений реанимации и интенсивной терапии (ОРИТ): что важно знать родственникам и пациентам
Отделения реанимации и интенсивной терапии, по мнению многих, долгое время являлись «закрытой» к посещению территорией, что постоянно вызывало общественный резонанс. Сейчас ситуация изменилась, и вопрос по допуску родственников решён на законодательном уровне. Однако, реанимация так и осталась особым отделением, где пациенты находятся на грани жизни и смерти.
Врач анестезиолог-реаниматолог, заведующий отделением реанимации и интенсивной терапии ожоговой травмы, начальник службы анестезиологии и реанимации Новосибирской областной больницы Игорь Саматов рассказал о специфике работы отделений реанимации, особенностях ведения пациентов и правилах посещения.
– Игорь Юрьевич, чем отличается реанимационное отделение от всех других? Какие существуют показания для госпитализации пациентов в реанимационное отделение?
– Реанимационное отделение отличается от всех других тем, что в это отделение пациент попадает, если в результате болезни, травмы или несчастного случая существует угроза его жизни. Это происходит, когда утрачены, частично или полностью, функции организма. Это состояние мы называем синдромом полиорганной недостаточности. И задача врача анестезиолога-реаниматолога состоит в том, чтобы протезировать нарушенные или утраченные жизненно важные функции, вплоть до прямого их замещения. Например, замещение функции внешнего дыхания мы осуществляем при помощи искусственной вентиляции лёгких, замещение почечной функции при почечной недостаточности путём проведения заместительной почечной терапии в различных вариантах – гемодиализ, гемофильтрация, гемодиафильтрация.
Выведение из состояния шока, борьба с другими критическими состояниями – задача врача-реаниматолога. Для этого проводится интенсивная терапия, что отражено в названии отделения. Мониторинг жизненно важных функций, лекарственная терапия, коррекция водно-электролитных и метаболических нарушений может проводиться в течение часов, суток, недель. Многие препараты, например, для поддержания сосудистого тонуса и обеспечения сердечного выброса, вводятся непрерывно через специальные устройства – шприцевые дозаторы (инфузоматы), искусственное парентеральное питание проводится с помощью объёмных дозаторов.
Соответственно, показаниями для помещения пациентов в отделения реанимации и интенсивной терапии являются угроза утраты либо уже произошедшая утрата жизненно важных функций организма при развитии любого критического состояния.
Также существует такое понятие как интенсивное наблюдение. Оно может потребоваться, например, в послеоперационном периоде после обширных операций.
– Каким оборудованием должно быть оснащено реанимационное отделение?
– Оснащены отделения реанимации и интенсивной терапии современным технологичным оборудованием согласно существующим на сегодняшний день порядкам оказания медицинской помощи по профилю «анестезиология-реаниматология» (такие порядки есть как для взрослых, так и для детей).
Каждое реанимационное койко-место оборудовано системой жизнеобеспечения: подводкой необходимых газов, электроснабжения, дыхательным аппаратом, монитором, обеспечивающим наблюдение в постоянном режиме за жизненно важными функциями, дозаторами лекарственных веществ, устройствами обогрева пациентов, дефибриллятором и многим другим сложным оборудованием.
– Существуют ли «специализированные» реанимации?
– Да, конечно. Например, в Областной клинической больнице в службу анестезиологии и реаниматологии входит девять структурных подразделений, из которых семь – профилированные отделения реанимации и интенсивной терапии (хирургического, гнойно-септического, ожогового, терапевтического, акушерского, педиатрического и неонатального профиля), а также отделение анестезиологии-реанимации и отделение переливания крови, гравитационной хирургии и гемодиализа.
– Какой врач считается лечащим врачом пациента, находящегося в отделении реанимации?
– У любого пациента, который находится в ОРИТ, два лечащих врача. Один лечащий врач – всегда по профилю основного заболевания, например, хирург (сосудистый, торакальный, абдоминальный и так далее), терапевт (кардиолог, невролог, пульмонолог и др.), акушер-гинеколог, педиатр, неонатолог. А второй лечащий врач – врач анестезиолог-реаниматолог. Дополнительно при необходимости могут привлекаться врачи-консультанты других специальностей.
– Часто врач, общаясь с родственниками, характеризует состояние пациента в реанимации как «стабильно тяжёлое», «крайне тяжёлое». Что означают эти термины?
– Для объективной оценки тяжести состояния пациента в интенсивной терапии существуют различные шкалы и индексы, они необходимы в повседневной клинической практике. Но на простом языке вполне употребимы выше названные термины. Самая главная смысловая нагрузка при этом ложится на слово «стабильное».
Дело в том, что состояние пациента, находящегося в реанимации, по определению не может быть лёгким. Пациент помещается в отделение реанимации только по абсолютным показаниям, когда его состояние действительно тяжёлое либо крайне тяжёлое. Если говорится о стабильно тяжёлом состоянии – это хорошо. Стабильное в этом случае означает, что врач-реаниматолог контролирует клиническую ситуацию.
Конечно, до выздоровления пациента еще далеко, но изменения в состоянии прогнозируемы, коррекция нарушений и протезирование утраченных функций организма полностью под контролем. Хуже, когда синдром полиорганной недостаточности прогрессирует, несмотря на проводимую интенсивную терапию – тогда можно говорить о нестабильном состоянии и прогрессировании отрицательной динамики.
Бывает, что пациенты находятся в тяжёлом состоянии долгое время, и родственники не понимают, почему это длится так долго. Например, пациенты с ожоговой болезнью или септические пациенты. Лечение может длиться недели, иногда месяцы, и пока состояние пациента тяжёлое, он будет находиться в реанимации. В такой ситуации большинство вопросов снимается после посещения больного родственниками и подробной личной беседы с врачом. По телефону мы не можем давать информацию, это обоснованное юридическое ограничение.
– Поясните, пожалуйста, что такое медикаментозная кома.
– Иногда проведение интенсивной терапии сопровождается погружением пациента в состояние медикаментозного сна, это важный компонент интенсивной терапии. Пациент должен «проспать» критическое состояние. Дело в том, что, находясь в критическом состоянии пациент попросту «горит» и очень важно понизить уровень метаболизма, чтобы сохранить резервы, ресурсы организма.
– Может ли пациент или его родственники отказаться от реанимационных мероприятий?
– Ни сам больной, ни родственники не могут отказаться от проведения реанимационных мероприятий. Право пациента на эвтаназию у нас в стране не прописано в законодательном порядке. С моей точки зрения, это правильно. Мы всегда боремся за жизнь пациента до последнего.
– При каких условиях пациента переводят из реанимационного отделения?
– Больного переводят из ОРИТ в профильное отделение при достижении состояния клинической стабильности, когда отпадает необходимость в круглосуточном интенсивном наблюдении за состоянием пациента. Это всегда происходит по согласованию с лечащим врачом и с заведующим профильным отделением.
– Сколько, в среднем, стоит пребывание пациента в реанимации? Из каких источников финансируется?
– Пребывание пациента в реанимационном отделении стоит очень дорого. Во всём мире отделения реанимации и интенсивной терапии по определению убыточные. Современные технологии интенсивной терапии финансово затратны, и наша страна, наша больница не исключение. И несмотря на это, пациент лечится столько, сколько необходимо. Никаких порядков, регламентирующих максимальное пребывание в ОРИТ, нет и быть не может. Основной источник финансирования – обязательное медицинское страхование, программа государственных гарантий.
– Какой порядок сегодня действует для посещения больных в реанимации? Каковы могут быть причины отказа?
– У нас есть внутренний приказ «О правилах посещения пациента в ОРИТ». Этим приказом регламентированы часы посещения и ряд других важных моментов, в частности, запрет на фото-, видеосъёмку, требование отключить все электронные устройства. Степень родства – обязательно первая линия, то есть муж, жена, дети, родители. Посетители, не являющиеся близкими родственниками, допускаются только в сопровождении последних. Посещение пациентов, находящихся в сознании, возможно только с их согласия. Правила посещения в виде памятки размещены на информационном стенде перед входом в каждое отделение реанимации и интенсивной терапии, а также на внешнем сайте больницы.
Причины отказа также регламентированы. В частности, наличие острого инфекционного заболевания, чаще всего, ОРВИ. И это, в первую очередь, в интересах пациентов, поскольку у многих из них ослаблен иммунитет. Не допускаются посетители в состоянии алкогольного и иного опьянения, дети в возрасте до 14 лет.
Кроме этого, если в палате выполняются инвазивные манипуляции или реанимационные мероприятия, в это время, конечно же, посещение временно не возможно. В данной ситуации родственников, которые уже находились в палате интенсивной терапии, могут попросить срочно покинуть отделение реанимации, что должно восприниматься с пониманием, адекватно. Посетитель после ознакомления с «Правилами посещения» ставит свою подпись, и документ сохраняется в истории болезни.
Главное, при посещении отделения реанимации – понимать, что здесь идёт ежеминутная борьба за жизнь, врачи и медсёстры выполняют свою далеко не простую работу и необходимо с пониманием отнестись к особенностям работы этого реанимационного отделения.





