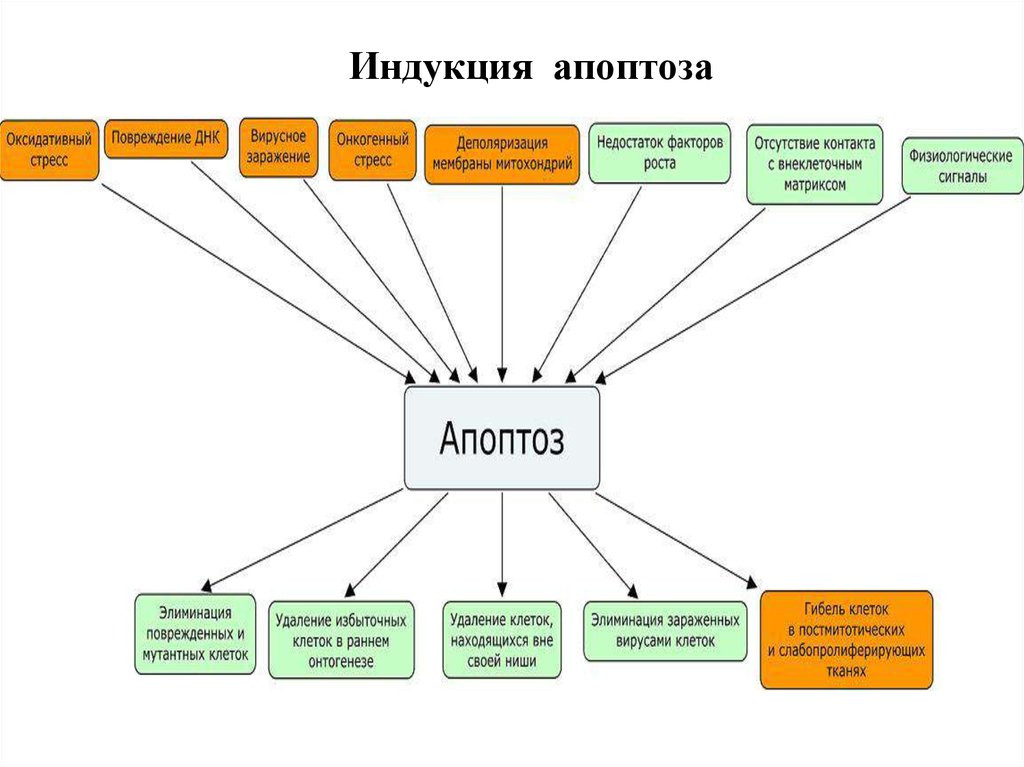
что такое апоптоз в каких случаях его наблюдают
МОЛЕКУЛЯРНАЯ МЕХАНИКА БОЛЕЗНИ
Концепция апоптоза как явления «запрограммированной» гибели клеток приобретает в последнее время все больше фактов и вариантов ее приложения к базовым вопросам современной медицины.
Термин «апоптоз» впервые был предложен в 1972 г. для обозначения генетически обусловленного процесса разрушения клетки и характеризуемого ее сжатием, агрегацией хроматина и деструкцией клеточного ядра. Апоптоз рассматривается как естественный биологический механизм, который способствует ликвидации «ненужных» клеток и тканей. Биологическая «цель» этого явления состоит в удалении нежелательных клеток в процессе индивидуального развития, при защитных реакциях, старении. Физиологическое назначение апоптоза состоит в селекции разновидностей и качества клеток внутри популяции, в том числе удалении клеток с генетическими дефектами, а также поддержании численности клеток тканевой популяции на функционально необходимом уровне.
Однако помимо общебиологического (общефизиологического) значения это явление оказывается значимым в процессах онкообразования, аутоиммунных патологиях, вирусных инфекциях, сердечно-сосудистых заболеваниях. Это представление получает также все большее число иллюстраций при изучении неврологических патологий. За последние пять лет, согласно информации Medline, по проблеме апоптоза опубликовано около 40 тыс. экспериментальных и клинических статей.
Биохимические и морфоцитологические признаки апоптоза выявляются в большом спектре экспериментальных нейродегенеративных расстройств: транзиторной церебральной ишемии, вызванной окклюзией церебральной артерии; интрацеребральной геморрагии; на моделях эпилептогенных судорог, локальном термическом повреждении мозга. Апоптоз включается в патологии любых проявлений ишемических и травматических повреждений нервной ткани, включая нарушения спинного мозга, деменциальные изменения, связанные с развитием болезней Альцгеймера, Паркинсона, сенильной деменцией, врожденными патологиями мозга и др. Таким образом, можно говорить о нейроапоптозе как новом патобиохимическом механизме нейродегенеративных расстройств широкого спектра.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ АПОПТОЗА
1. Нарушение энергетического потенциала митохондрий.
2. Образование активных форм кислорода (АФК).
3. Запуск «специализированных» биохимических систем.
5. Морфологическая гибель клетки, ткани, организма.
Среди факторов запуска апоптоза следует отметить образование активных форм кислорода как «извращенного» пути окислительного метаболизма в клетке. Считается, что повреждения, развивающиеся в результате аноксии или ишемии ткани любого уровня, обязаны в первую очередь образованию АФК. Первичным источником АФК оказываются митохондрии, которые играют ключевую роль в энергетическом обеспечении клетки. Ныне существует обобщенное клиническое понятие «митохондриальная патология»: повреждение мембран митохондрий ведет к образованию супероксидных радикалов, которые, реагируя с NO, образуют пероксинитриты, «повреждающие» молекулы АФК.
Факторы, последовательно включающиеся в апоптоз:
2.Образование АФК, которые стимулируют синтез провоспалительных цитокинов, включающихся в каскад апоптических процессов.
4. Включение каскада протеолитических реакций, приводящих к расщеплению белков ядерного матрикса, дестабилизации структуры хроматина ядер, фрагментации ДНК, нарушению репликационной и метаболической функций клетки. Среди ферментов, причастных к разветвленной цепи апоптоза, ведущее место принадлежит каспазам, относящимся к семейству 1-интерлейкин-конвертирующих протеаз.
Баланс про- и антиапоптических механизмов связан с оксидом азота (NO), различные пути образования которого могут определять как цитотоксическое, так и цитопротекторное его действие. Длительная генерация NO провоцирует развитие апоптоза: усиливается синтез белка р53 и активируются протеазы из семейства каспаз.
Биохимические и цитоморфологические исследования апоптоза выявляют несколько стадий его развития в поврежденной нервной ткани: непосредственную и отсроченную. Как правило, исходное повреждение ткани не ограничивается областью воздействия разрушающей силы, а, продолжаясь во времени, захватывает первично интактные клетки и приводит к расширению очага повреждения.
Поскольку апоптоз рассматривается в качестве патохимического механизма клеточной гибели, представляет собой фазный процесс и, следовательно, имеет обратимые этапы, возможно рассмотрение подходов к фармакологическому вмешательству в его регуляцию. Существенной оказывается оценка условий, благодаря которым, переходя необратимую грань, апоптоз приводит к тотальным последствиям, гибели большого массива функционально значимых клеток и смерти всего организма. К этим условиям относятся характер и величина травмирующего воздействия, степень сбалансированности клеточных биохимических систем, противостоящих необратимому развитию апоптоза, возможность своевременного применения реабилитационных мероприятий защиты структур мозга, кардиоваскулярной системы и организма в целом.
РОЛЬ НЕЙРОПЕПТИДОВ И НЕЙРОТРОФИНОВ
Существует определенная параллель между информацией об участии нейропептидов и нейротрофических факторов роста в патогенезе неврологических расстройств и причастностью этих химических регуляторов к нейроапоптозу. Среди нейротрофических ростовых факторов (см. «МГ» № 30 от 17.04.02) выявляются те, которые играют роль индукторов апоптических процессов или, наоборот, противодействующих развитию нейроапоптоза. Например, в исследованиях последних месяцев подтверждено участие фактора некроза опухоли (TNF-() в апоптозе глиальных и нейрональных клеток как следствии аутоиммунной нейропатологии и патологии мультисклероза. Ассоциируемое с болезнью Гентингтона образование свободнорадикальных продуктов, провоцируемое в эксперименте внесением дофамина, ингибировалось в нейронах стриатума нейротрофическим фактором мозга (BDNF).
АПОПТОЗ В КАРДИОВАСКУЛЯРНЫХ КЛЕТКАХ
Признаки апоптоза выявляются также при различных формах сердечно-сосудистых патологий: дисфункции эндотелия, «чрезмерном» напряжении сосудистой стенки, ишемических и реперфузионных ее нарушениях, атеросклеротических изменениях, инфаркте миокарда, ишемическом инсульте и др. В перикардиальной жидкости пациентов с ишемической патологией миокарда обнаружен митогенактивирующий белок р38, участвующий в запуске апоптических процессов. Известно также, что при кардиоваскулярных расстройствах, сочетающихся с диабетом, в миоцитах и эндотелиоцитах обнаруживаются активированные апоптозные продукты. Недавно были опубликованы клинические результаты, согласно которым определенные белки апоптозного каскада могут быть использованы как маркеры повреждения миокарда при стадийной ИБС.
Как известно, патология «гипертонического сердца» сопровождается гипертрофией левого желудочка, ведущей к ремоделированию миокарда, недостаточной васкуляризации, фиброзу, уменьшению числа функциональных кардиомиоцитов и сократительной способности сердца в целом. За все эти явления ответствены апоптозные процессы, спровоцированные хронической ишемией и перегрузкой больного сердца. Исследования последнего периода показывают, что апоптозная гибель кардиомиоцитов служит решающим фактором в переходе к компенсаторной гипертрофии и нарушению насосной функции сердца при артериальной гипертензии. Условия, провоцирующие экспрессию химических механизмов апоптоза в «перегруженном» сердце, включают чрезмерное механическое напряжение миоцитов, гипоксию и окислительный стресс, активацию нейрогуморальных факторов и цитокинов. Все эти явления сопряжены между собой и составляют звенья единого патогенетического процесса.
Особенно значимы исследования, связанные с ангиотензином II и образующим его ферментом АПФ. Исследования роли ангиотензина II в механизмах окислительного стресса и эндотелиальной дисфункции логично привели к рассмотрению роли этого пептида в индукции апоптоза кардиальных, васкулярных и эндотелиальных клеток. Принципиальным оказывается вывод, что повышенный уровень ангиотензина II сопряжен с активностью некротического и трансформирующего ростовых факторов, а также специфических апоптозных белков (bcl-2, p53), особых ферментов (каспаз), каскадная динамика которых приводит к деградации молекулы ДНК на фрагменты и последующей «запрограммированной» гибели клетки.
Проапоптозный, патогенетический, эффект ангиотензина II может быть заблокирован использованием соответствующих препаратов.
В настоящее время открыт, по сути, базовый биохимический механизм неврологических, кардиоваскулярных, онкологических и других патологий. Очевидно, последующие работы и исследования специфической роли систем химических регуляторов представят новые возможности диагностики и терапии этих заболеваний.
Апоптоз – программируемая клеточная смерть
Природа снабдила клетки не только многочисленными механизмами защиты и репарации, но и целым набором «суицидальных» инструментов. Образно говоря, в каждой клетке есть своя собственная «гильотина».
Термин «апоптоз» состоит из двух греческих слов и означает в буквальном смысле «опадание листьев». Апоптозу подвергаются клетки, закончившие цикл своего развития, – стареющие, поврежденные, мутантные, инфицированные. В многоклеточных организмах апоптоз клетки задействован в процессах дифференциации и морфогенеза, а также в поддержании клеточного гомеостаза, формировании и функционировании иммунной системы.
В настоящее время продолжаются активные исследования регуляторов и активаторов апоптоза для установления более точной картины этого процесса. Хотя механизм апоптоза клетки уже установлен.
Существует множество определений понятия «апоптоз». В некоторых источниках под ним подразумевают явление программируемой клеточной смерти, сопровождаемой набором характерных цитологических признаков (маркеров апоптоза) и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов (то есть изменений в строении и функционировании клетки, характерных для этого процесса). Другие источники описывают клеточный апоптоз как форму гибели клетки, проявляющуюся в уменьшении ее размера, конденсации (уплотнении) и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода содержимого клетки в окружающую среду.
Механизм апоптоза
Как включается в клетке программа апоптоза? Факторы и их пусковые механизмы мы можем условно разбить на две группы:
– митохондриальный механизм;
– рецепторный механизм.
Митохондриальный механизм
Возникает при неудовлетворительном состоянии клетки, которое может быть обусловлено различными видами облучения, изменением температуры, действием химических веществ, токсинов, стрессовыми ситуациями, нарушением питания клетки и недостатком кислорода в тканях.
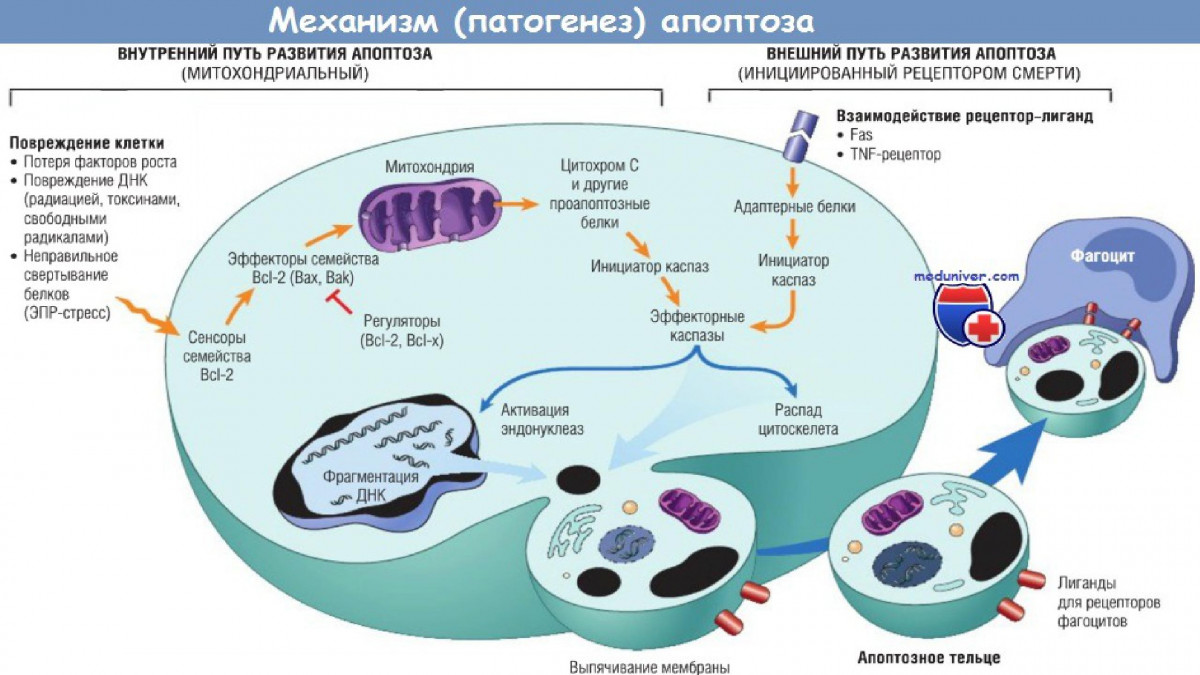
При всем многообразии причин запуска механизм развития апоптоза однотипен. Он связан с повреждением митохондриальной мембраны, что приводит к выходу в цитоплазму цитохромов (дыхательных ферментов, прочно связанных с мембранами митохондрий, осуществляющих в клетке перенос электронов и водорода от окисляемых органических веществ к молекулярному кислороду, при этом образуется богатое энергией соединение – АТФ). Цитохром вместе с цитоплазматическим фактором APAF-1 (Apoptose protease activation factor), неактивной каспазой и АТФ составляют апоптосомальный комплекс. Фактор APAF-1 активирует каспазы (особые протеолитические ферменты, являющиеся цистеиновыми протеазами и представленные в клетке множественными вариантами). Предполагается, что эти ферменты образуют протеолитический каскад, взаимно активируя друг друга и приводя тем самым к деградации клетки. Также в реализации этих процессов участвуют митохондриальные белки семейства Всl-2.
Рецепторный механизм
Развитие апоптоза происходит постепенно. Сигнал для начала процесса клетка получает при активации особых рецепторов, находящихся на ее поверхности. В данном случае клетка вполне жизнеспособна, но с позиций целостного организма ей посылается сигнал о «самоликвидации». Рецепторы детектируют присутствие межклеточных сигналов и в ответ на это быстро запускают внутриклеточный механизм реализации апоптоза, объединяясь в особую группу – рецепторов гибели, отличающихся от других рецепторов наличием в цитоплазматической части клетки специального «домена смерти», необходимого для включения сигнала, приводящего к апоптозу. Среди таких рецепторов наиболее известен рецептор Fas, который взаимодействуя с соответствующим лигандом (лигандом FasL), трансмембранным белком Т-киллера, активируется и запускает программу смерти клетки, инфицированной вирусом.
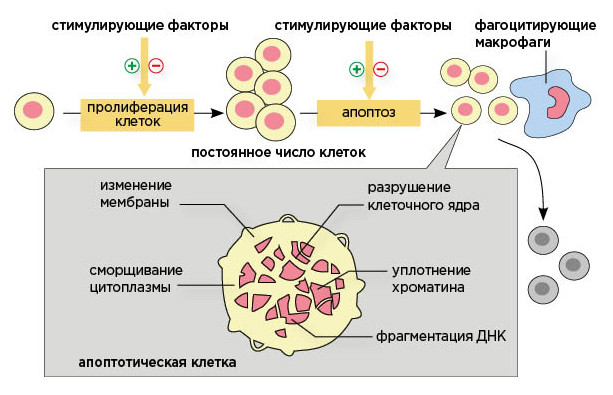
Пролиферация клеток и апоптоз.
Другие активаторы апоптоза
Активировать апоптоз могут также различные метаболиты и гормоны: противовоспалительные цитокины, стероидные гормоны, окись азота и свободные радикалы. Все эти факторы в свою очередь вызывают чрезмерное повреждение хромосом, многочисленные разрывы ДНК, нарушения их конформации. Пусковым моментом могут стать также повреждения внутриклеточных мембран и перекисное окисление липидов.
Для более глубокого понимания механизмов регуляции необходимо упомянуть некоторые воздействия и факторы, играющие немаловажную роль в развитии апоптоза. В 90-х годах ХХ века был открыт ряд генов, участвующих в регуляции этого процесса. Один из них кодирует белок р53, являющийся активатором апоптоза. Повышение уровня белка р53 происходит в ответ на повреждения ДНК, при этом он индуцирует процесс разными механизмами: влиянием на клеточный цикл, стимуляцией экспрессии Fas-рецептора, воздействием на соседние клетки и пр. При действии белка р53 увеличивается время репарации ДНК, что защищает организм от распространения клеток с опасными мутациями. Важно подчеркнуть, что р53-зависимый апоптоз элиминирует из организма не только поврежденные клетки, но и клетки, в которых наблюдается нерегулируемая стимуляция процессов пролиферации.
Клетка подвергается апоптозу, если в ядре происходит повреждение ДНК, которое не может быть исправлено системой репарации. За данным процессом следит белок, кодируемый геном р53.
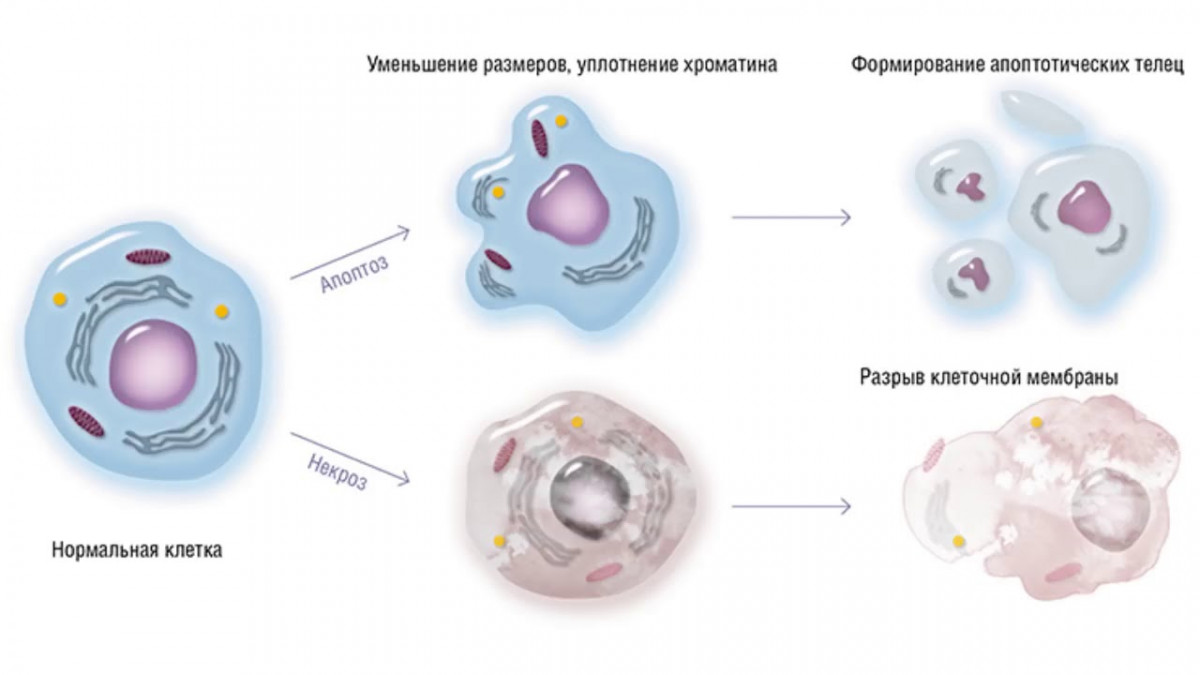
Механизм развития апоптоза: при апоптозе происходят необратимые изменения клеточной морфологии. Клетка уменьшается и фрагментируется на апоптотические тельца, при этом клеточная мембрана остается неповрежденной. Это предотвращает вытекание токсических и иммуногенных веществ в межклеточное пространство. В случае некроза клетка распухает, мембрана разрывается и содержимое клетки выходит наружу, что приводит к воспалению.
Апоптоз и некроз
Повреждение клеточных структур, ведущее к апоптозу, не должно быть чрезмерным, иначе процесс ее гибели становится неуправляемым и представляет собой уже другую форму гибели клетки – некроз.
Некроз – это патологический процесс, запускающийся в ответ на какое-либо внешнее или внутренне повреждение (инфекция, химическое воздействие, облучение, недостаточное кровоснабжение и т. д.). Некроз проявляется в набухании, денатурации и коагуляции цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки. Основу некроза составляет нарушение целостности мембраны, обеспечивающей изоляцию клетки от внешней среды. Происходит выход лизосомальных ферментов из лизосом, которые и переваривают содержимое клетки, клетка набухает, происходит разрыв мембраны с разрушением субклеточных структур вследствие осмотического шока, при этом ДНК подвергается неконтролируемой фрагментации. Содержимое клетки выбрасывается во внеклеточную среду, где поглощается фагоцитами, что приводит к развитию воспалительной реакции в окружающих тканях.
В чем отличие некроза от апоптоза? При апоптозе размер клетки, наоборот, уменьшается, мембрана уплотняется, образуются вздутия, завершающиеся формированием клеточных фрагментов, содержащие обломки ядер (апоптические тельца). Контакты с соседними клетками ослабляются, ДНК подвергается строго упорядоченной фрагментации, поскольку ее нити обрываются только между нуклеосомами (структуры, в которых упакованы ДНК). При апоптозе сохраняется целостность мембран, органеллы выглядят морфологически интактными, а продукты дробления клетки, апоптозные тельца, представляют собой отдельные фрагменты, окруженные мембраной.
Таким образом, судьба клеток, подвергшихся апоптозу и некрозу, различна. Некротическая клетка лопается, и ее содержимое оказывается в межклеточном пространстве, вызывая повреждение соседних клеток и инициируя воспаление. Апоптические же клетки сохраняют непроницаемость и очень быстро поглощаются фагоцитами. Объясняется это тем, что на поверхности клетки в процессе апоптоза появляется ряд молекул (гликопротеины, фосфатидилсерин и др.), распознаваемых фагоцитами и служащих сигналом для осуществления фагоцитоза. Основные различия между апоптозом и некрозом отражены в таблице 1.
Таблица 1. Основные различия между апоптозом и некрозом
Показатель
Апоптоз
Некроз
Пусковой фактор
Повышение проницаемости мембран митохондрий или сигнал, воспринимаемый мембранными рецепторами
Неадекватные условия среды, токсические агенты
Скорость развития
1–4 ч
Менее часа
Причины гибели клетки
Нарушение энергетики клетки, деградация ДНК
Нарушение целостности мембраны, осмотические процессы
Изменение размера клетки
Уменьшение (сморщивание)
Увеличение (набухание)
Изменение ядра
Конденсация хроматина, фрагментация
Набухание
Изменение в цитоплазме
Конденсация цитоплазмы, уплотнение гранул
Лизис гранул
Изменение клеточной мембраны
Потеря микроворсинок, образование вздутий, уплотнений
Нарушение целостности
Состояние ДНК
Упорядоченная (межнуклеосомная) деградация
Неупорядоченная деградация
Энергозависимость
Зависит
Не зависит
Стадии апоптоза
Механизмы апоптоза сложны и многообразны. Они представляют собой сложнейший молекулярный каскад, изучением которого занимаются многие лаборатории по всему миру. Несомненная важность этих исследований в аспекте онкологии и геронтологии доказана успехами терапии онкологических заболеваний индукторами апоптоза раковых клеток.
В развитии апоптоза выделяют три стадии:

Индукция апоптоза.
Итак, апоптоз: активация процесса начинается с получения клеткой сигнала о том, что ее гибель необходима для дальнейшей жизнедеятельности организма. Индукторами апоптоза могут быть как внешние (внеклеточные) факторы, так и внутриклеточные сигналы. Сигнал воспринимается рецептором и далее последовательно передается молекулам-посредникам (мессенджерам) различного порядка и достигает ядра, где происходит включение программы клеточного «самоубийства». В ядре регистрируются первые морфологические признаки апоптоза – конденсация хроматина с формированием его осмиофильных скоплений, прилежащих к ядерной мембране. Позже появляются инвагинации (вдавления) ядерной мембраны, и происходит фрагментация ядра. В основе деградации хроматина лежит ферментативное расщепление ДНК. Сначала образуются фрагменты, включающие 700, 250, 70 тысяч пар оснований, затем – фрагменты, содержащие 30–50 тысяч пар оснований. После реализации этого этапа процесс становится необратимым.
Затем наступает межнуклеосомная дезинтеграция ДНК, то есть разрывы нитей ДНК, находящихся между нуклеосомами. Отделившиеся фрагменты ядра, ограниченные мембраной, называют апоптотическими тельцами. В цитоплазме происходит расширение эндоплазматического ретикулума, конденсация и сморщивание гранул.
Признаки апоптоза клетки
Важнейшим признаком апоптоза является снижение трансмембранного потенциала митохондрий и выход в цитоплазму различных апоптогенных факторов (цитохрома, прокаспаз, апоптоз-индуцирующего фактора). Именно нарушению барьерной функции митохондриальных мембран отводят ключевую роль в развитии многих типов апоптоза. Клеточная мембрана утрачивает ворсинчатость и образует пузыревидные вздутия. Клетки округляются и отделяются от субстрата. На поверхности клетки экспрессируются различные молекулы, распознаваемые фагоцитами, в результате чего происходит поглощение тела клетки другими клетками и его деградация в окружении лизосом фагоцитарных клеток.
Роль апоптоза в физиологических процессах организма
Современные сведения показывают, что имеется взаимосвязь между нарушениями регуляции апоптоза и целым рядом возрастных патологий и фенотипов старения. Одна из гипотез объяснения молекулярно-генетических механизмов старения организма постулирует: старение организма – это, по сути, апоптоз, старение ключевых клеток, гибель которых способна повлиять на физиологию всего организма. До сих пор идут дискуссии о роли апоптоза в процессе старения, при этом часть исследователей являются сторонниками теории клеточного апоптоза, придерживаясь мнения, что старение происходит в результате того, что в организме гибнет больше клеток, чем рождается, а отмирающие функциональные клетки заменяются соединительной тканью. Исходя из этой теории, старость – это болезнь, которую можно и нужно лечить, а программу старения организма возможно вывести из строя и тем самым выключить механизм, сокращающий нашу жизнь.
Людмила Бравинская, косметолог-методист, Одесский медицинский университет, Одесса
Что такое апоптоз в каких случаях его наблюдают
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
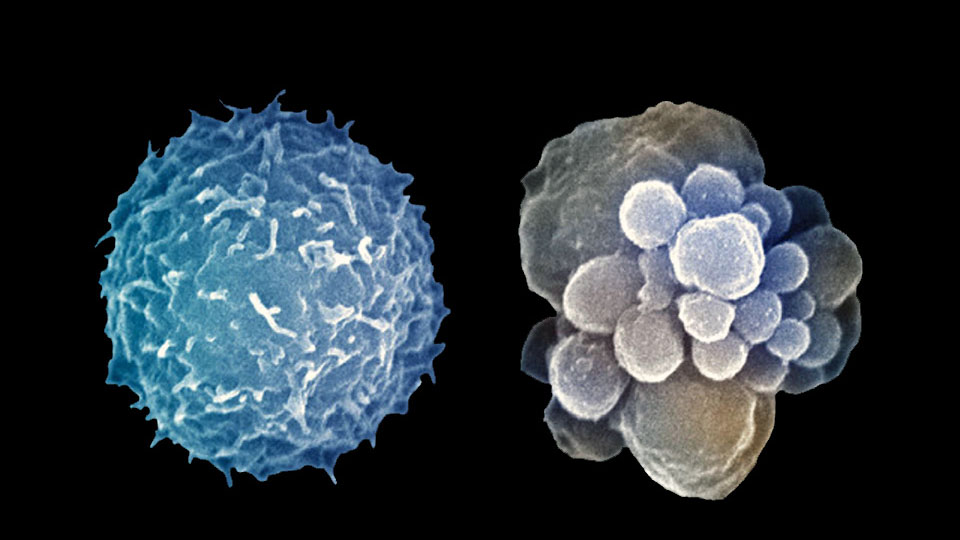
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
На молекулярном уровне при апоптозе происходит саморазрушение генома на мельчайшие фрагменты, осуществляемое ферментами самой клетки; в итоге при электрофорезе образующихся клеточных компонентов в полиакриламидном геле выявляется характерная «лестница» из фрагментов ДНК.
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
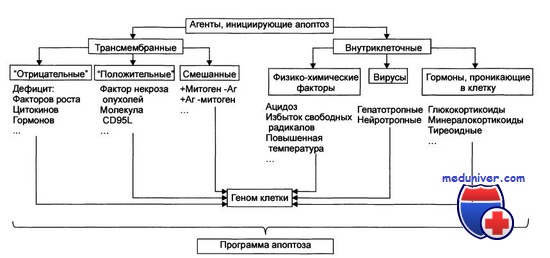
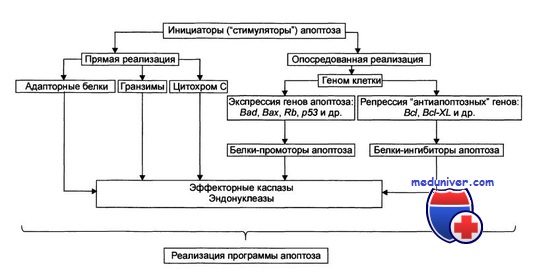
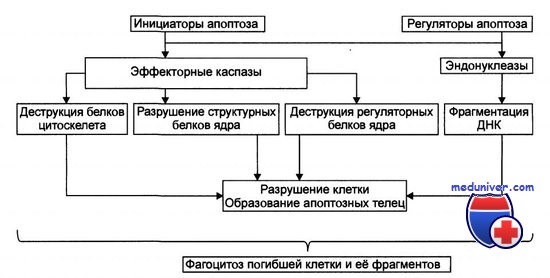
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»