что такое андрогенная депривационная терапия
Продолжительность андроген-депривационной терапии при раке простаты высокого риска: рандомизированное исследование III фазы
Актуальность
Долгосрочная андроген-депривационная терапия (АДТ) в комбинации с лучевой терапией (ЛТ) является стандартным видом лечения у пациентов с локализованным раком предстательной железы высокого риска (РПЖВР). Однако, оптимальная продолжительность АДТ пока не определена.
Цель исследования
Целью этого рандомизированного исследования, направленного на подтверждение превосходства, было сравнение результатов ЛТ в комбинации с АДТ продолжительностью 36 или 18 месяцев.
Дизайн, условия и участники исследования
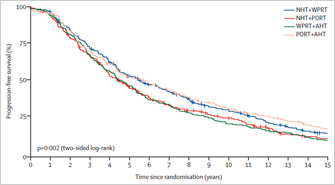
С октября 2000 г. по январь 2008 г. были рандомизированы 630 пациентов с РПЖВР: 310 в группу ЛТ на область тазовых лимфоузлов и простаты в сочетании с АДТ продолжительностью 36 месяцев (группа долгой АДТ) и 320 в группу ЛТ на те же области с АДТ продолжительностью 18 месяцев (группа короткой АДТ).
Определение результатов и статистический анализ
Общая выживаемость (ОВ) и качество жизни (КЖ) были основными конечными точками. Показатели ОВ сравнивались с помощью модели регрессии Кокса, а данные по КЖ анализировались с помощью модели со смешанными эффектами.
Результаты и ограничения
При медиане периода наблюдения, равной 9.4 годам, 290 пациентов умерли (147 в группе долгой терапии по сравнению с 143 в группе короткой терапии). Пятилетние показатели ОВ (95%-ный доверительный интервал) составили 91% в группе долгой терапии (88–95%) и 86% в группе короткой терапии (83–90%), p = 0.07. Анализ КЖ продемонстрировал значимые различия (p
Что такое андрогенная депривационная терапия
Лучевая терапия рака предстательной железы с адъювантной андроген-депривационной терапией (АДТ) улучшает время без прогрессирования болезни по сравнению с неоадъювантной АДТ
По-прежнему нет ясности в отношении влияния последовательности АДТ и лучевой терапии на исходы рака простаты. Авторы крупного метаанализа, опубликованного в Журнале клинической онкологии (ASCO), оценили эффективность неоадъювантной и адъювантной АДТ на фоне лучевой терапии.
Для поиска использовались базы данных MEDLINE (1966-2018), Embase (1982-2018), ClinicalTrials.gov и материалы конференций (1990-2018), в которых были идентифицированы 2 рандомизированных исследования – Ottawa 0101 и NRG 9413 онкологической группы по лучевой терапии. В исследовании Ottawa 0101 пациенты рандомизировались в группы неоадъювантной/параллельной АДТ или адъювантной кратковременной АДТ после лучевой терапии. В исследовании 9413 с факториальным дизайном рандомизации 2×2 больные также распределялись в группы неоадъювантной/параллельной АДТ или адъювантной кратковременной АДТ. В настоящем метаанализе первичной конечной точкой была выживаемость без прогрессирования (ВБП).
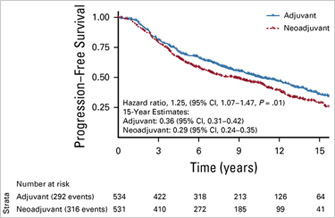
Медиана наблюдения составила 14,9 года. Всего было включено 1065 пациентов (531 в группу неоадъювантной терапии и 534 – в группу адъювантной терапии). ВБП была значительно лучше в группе адъювантного подхода (отношение рисков [HR] 1,25, P=0,01). Так, 15-летняя ВБП составила 29% и 36% соответственно.
Частота биохимических рецидивов (HR=1,37; P=0,002), частота отдаленных метастазов (HR=1,40; P=0,04) и выживаемость без метастазов (HR=1,17; P=0,050) также были лучше в случае адъювантной терапии.
Отличий в токсичности 3 степени и выше отмечено не было: например, частота нежелательных явлений со стороны органов ЖКТ составила 2% против 3% (P=0,33), а со стороны органов мочеполовой системы – 5% против 5% (P=0,76) в группе неоадъювантной и адъювантной терапии.
Авторы сделали вывод, что последовательность лучевая терапия – адъювантная АДТ представляется более эффективной по сравнению с последовательностью неоадъювантная АДТ и лучевая терапия у больных локализованным раком предстательной железы без какого-либо увеличения долгосрочной токсичности.
Источник: Daniel E Spratt, et al. J Clin Oncol. 2021 Jan 10; 39(2): 136-144.
Комментарий эксперта
В клинической онкологии встречаются ситуации, когда два негативных исследования в совокупности приводят к позитивному результату: минус на минус = плюс. В области лучевой терапии мы уже обсуждали прежде совокупный анализ [1] двух независимых незаконченных рандомизированных испытаний 3-й фазы – STARS и ROSEL, который был опубликован в журнале Lancet Oncology в 2015 году и показал улучшенную 3-летнюю общую выживаемость среди пациентов с 1-й стадией НМРЛ, рандомизированных на нехирургическое лечение (3-летняя общая выживаемость 95% у пациентов, рандомизированных на стереотаксическую аблативную ЛТ, против 79% у пациентов, рандомизированных на лобэктомию; HR 0,14; p=0,037). Несколько месяцев назад мы обсуждали на этих страницах объединенный анализ [2] двух негативных исследований по добавлению ЛТ к пембролизумабу у пациентов с мНМРЛ. В объединенном анализе была значительная и достоверная разница в медиане общей выживаемости (8,7 мес. против 19,2 мес.; HR 0,67; p=0,0004) при добавлении ЛТ. И в том, и в другом случае – совокупные анализы, если в них верить, должны были бы глобально поменять клинический подход и тактику лечения: пациентов с 1-й стадией НМРЛ более не оперировать, а пациентов с 4-й стадией НМРЛ отправлять сразу на ЛТ, как только назначается пембролизумаб. Для таких глобальных изменений в клинической практике нужны дополнительные проспективные исследования, которые убедят и радиотерапевтов, и хирургов, и медицинских онкологов. И главное, конечно, самих пациентов, за которыми остается последнее слово и выбор тактики лечения.
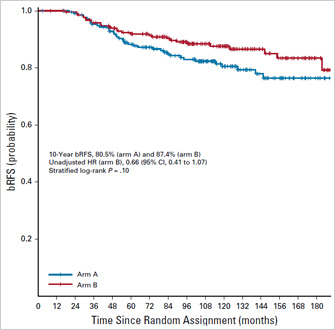
Что же касается последовательности АДТ и ЛТ при лечении локализованного рака предстательной железы – тут все должно быть намного проще. Рандомизированное исследование Ottawa 0101 было опубликовано в JCO в 2019 году [3]. 432 пациента с РПЖ получили 6 месяцев АДТ и были рандомизированы на стандартную дистанционную лучевую терапию на предстательную железу (76 Грей за 38 фракций) либо с самого начала АДТ (сочетанное-адъювантное лечение), либо через 4 месяца после начала АДТ (неоадъювантное-сочетанное лечение). 10-летняя выживаемость без биохимического рецидива была выше у пациентов, рандомизированных на сочетанное-адъювантное лечение (87,4% против 80,5%), но без статистической достоверности (p=0,10).
Очень схожую 7-процентную разницу в показателях 10-летней выживаемости без прогрессирования опубликовали авторы исследования RTOG 9413 в 2018 году в журнале Lancet Oncology [4]. Если сравнивать 317 пациентов, получивших ЛТ (70,2 Грей за 39 фракций) на предстательную железу до начала 4-месячного курса АДТ, и 316 пациентов, которые сначала получили 2 месяца АДТ, а потом ЛТ во время 3-го и 4-го месяца АДТ, то 10-летняя выживаемость без прогрессирования была 23,5% против 30,2% в пользу адъювантной АДТ.
Доктор Спратт, который выступал на Конгрессе RUSSCO в ноябре 2020 года [5], и ведущие эксперты по РПЖ в Северной Америке провели совокупный метаанализ [6] этих двух крупных исследований и установили, что 7-процентая разница между показателями 15-летней ВБП (29% против 36%) при большем количестве пациентов имеет статистическую достоверность (отношение рисков [HR] 1,25; P=0,01).
В США в большинстве центров до сего момента практиковалось неоадъювантное-сочетанное лечение. Это было связано с давно опубликованными доклиническими исследованиями (Zietman 1997 [7], Granfors, 1997 [8], Kaminski, 2003 [9]), на которых базировались потом все клинические протоколы в США. Такой подход легко было объяснить и для самого себя, и для пациента: «сначала опухоль станет меньше под воздействием АДТ, а затем ЛТ – при равных дозах – будет более эффективной». Честно говоря, такой подход был проще для врачей и пациентов – можно было бы не спешить, у радиотерапевтов было аж 2 месяца после начала АДТ, чтобы пригласить пациента на консультацию, потом провести предлучевую топометрическую подготовку и не спешить с оконтуриванием и началом лучевой терапии. Часто пациенты планировали свою жизнь – важные события, путешествия – в эти два месяца до начала ЛТ. Что ж, теперь нужно не зевать, а начинать лечение сразу, как мы привыкли с пациентами других нозологий – раком пищевода, легкого. При этом «теперь» – это не сегодня, а через несколько месяцев, когда все пациенты будут вакцинированы от коронавируса и визит в клинику лучевой терапии не будет для них потенциально опасным. Важно помнить, что в совокупном анализе др. Спратта и его команды после 15 лет наблюдения не было достоверной разницы в опухоль-специфической и общей выживаемости между двумя группами пациентов. Поэтому для 75-летнего пациента с локализованным раком предстательной железы среднего риска на сегодняшний день я бы порекомендовал начать с АДТ, получить вакцину от коронавируса и уже потом вернуться в клинику для прохождения курса лучевой терапии.
Андроген-депривационная терапия приводит к повышению риска сердечной недостаточности
Актуальность
Андроген-депривационная терапия (АДТ) нередко используется у пациентов с раком предстательной железы. Согласно результатам предыдущих исследований, выявлена ассоциация между АДТ и сердечной недостаточностью. Однако количество пациентов в таких исследованиях было не большим.
Методы
Исследователи из Тайваня инициировали когортное исследование с включением пациентов с раком предстательной железы, поучающих АДТ.
Исследователи проанализировали данные из Taiwan Longitudinal Health Insurance Database. В исследование были включены 1244 мужчины, которые получали АДТ, и 1806 пациентов, которым такая терапия не проводилась.
Конечной точкой исследования являлась частота развития сердечной недостаточности в течение 1 года АДТ.
Результаты
Заключение
Андроген-депривационная терапия ассоциирована с повышением частоты развития сердечной недостаточности у пациентов с раком предстательной железы.
Источник: Hui‐Han Kao, Li‐Ting Kao, I‐Hsun Li, et al. J Clin Pharmacol 2018.
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Интермиттирующая андроген-депривационная терапия при раке простаты: критический обзор исследований фазы 3
Intermittent androgen-deprivation therapy in prostate cancer: a critical review focused on phase 3 trials
Sciarra A, Abrahamsson PA, Brausi M, Galsky M, Mottet N, Sartor O, Tammela TL, Calais da Silva F.
Источник
Department of Urology, University Sapienza, Rome, Italy. Electronic address: sciarra.md@libero.it.
Интермиттирующая андрогенная депривация (ИАД) у пациентов с раком предстательной железы (РПЖ) была предложена для того, чтобы отсрочить развитие резистентности к кастрации и уменьшить побочные эффекты и стоимость андроген-депривационной терапии (АДТ).
Цель
В данном обзоре проведен анализ: онкологических результатов и качества жизни (КЖ) в рандомизированном исследовании 3 фазы, сравнивающем ИАД и непрерывную АДТ прогностических параметров интермиттирующей андроген-депривационной терапии.
Доказательная база
Поиск проводился в базах данных Medline и Cochrane Library (первичные поля: новообразования простаты и интермиттирующая андрогенная терапия; вторичные поля: рандомизированные исследования, выживаемость, качество жизни, предикторы) без языковых ограничений.
Синтез доказательств
Мы нашли семь широко описанных исследований 3 фазы рандомизировавших 4675 пациентов на группы интермиттирующей андрогенной депривации и непрерывной АДТ. Были доступны и другие рандомизированные исследования, изучавшие ИАД, но имеющиеся данные были ограничены и опубликованы только предварительные результаты. Во всех семи исследованиях пациенты провели большую часть своего времени на АДТ.
Индукционный период составлял от 3 до 8 месяцев; во всех, кроме одного исследования, уровень ПСА для прекращения АДТ был менее 4 нг/мл. Средний период наблюдения составил 40-108 месяцев.
В совокупности эти исследования поддерживают концепцию, согласно которой, в основном в метастатических случаях, интермиттирующая андрогенная депривация может показывать онкологические результаты, аналогичные непрерывной АДТ. С точки зрения общей выживаемости, отношение рисков ИАД и непрерывной АДТ были очень похожи (диапазон: 0,98-1,08). Преимущества по качеству жизни при ИАД были, в лучшем случае, довольно скромными. На фоне интремиттирующей андрогенной депривации качество жизни, скорее всего, зависит от продолжительности периодов вне лечения и скорости восстановления уровня тестостерона.
Выводы
Факты свидетельствуют о том, что интермиттирующая андрогенная депривация не уступает непрерывной АДТ. Для определения того, способна ли интермиттирующая андрогенная депривация предотвратить долгосрочные осложнения АДТ, этих данных недостаточно. Оправдан более точный сравнительный анализ с прицелом на качество жизни.
Андроген-депривационная терапия в лечении рака предстательной железы и риск развития инфаркта миокарда и инсульта: общенациональное Датское когортное популяционное исследование
Андроген-депривационная терапия (АДТ), судя по всему, увеличивает риск сердечно-сосудистых заболеваний, в том числе инфаркта миокарда (ИМ) и инсульта, но данные противоречивы.
Цель
Исследовать связь между АДТ и риском инфаркта миокарда и инсульта у датских мужчин с раком простаты.
Дизайн, установки и участники
Было проведено национальное когортное исследование всех пациентов с раком простаты, зарегистрированных в Датском канцер-регистре с 1 января 2002 по 2010 год.
Результат измерений и статистический анализ
Мы использовали регрессионный анализ Кокса для оценки отношения рисков (ОР) инфаркта м
Результаты и ограничения
Из 31 571 больного раком простаты 9204 (29%) получали гормональную терапию и 2060 (7%) была выполнена орхэктомия. У пациентов, получавших гормональную терапию, отмечался повышенный риск инфаркта миокарда и инсульта с поправкой на отношение рисков (ОР) 1,31 (95% доверительный интервал [ДИ], 1,16-1,49) и 1,19 (95% ДИ, 1,6-1,35), соответственно, по сравнению с пациентами, не получавшими АДТ. Мы не обнаружили повышенного риска развития инфаркта миокарда (ОР: 0,90, 95% ДИ, 0,83-1,29) или инсульта (ОР: 1,11, 95% ДИ, 0,90-1,36) после орхэктомии. Одним из ограничений исследования является то, что информация о прогностических факторах образа жизни не была включена и это невключение, возможно, искажало наши оценки.
Выводы
В этом общенациональном когортном исследовании более 30 000 больных раком простаты мы обнаружили, что гормональная терапия была связана с повышенным риском инфаркта миокарда и инсульта. В отличие от этого, мы не нашли подобной ассоциации после орхэктомии.
Ключевые слова: Кастрация, гонадотропин-рилизинг гормон, инфаркт миокарда, орхэктомия, новообразования простаты, инсульт.
Androgen-deprivation therapy in treatment of prostate cancer and risk of myocardial infarction and stroke: a nationwide Danish population-based cohort study