что значит кишечник дифференцирован
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
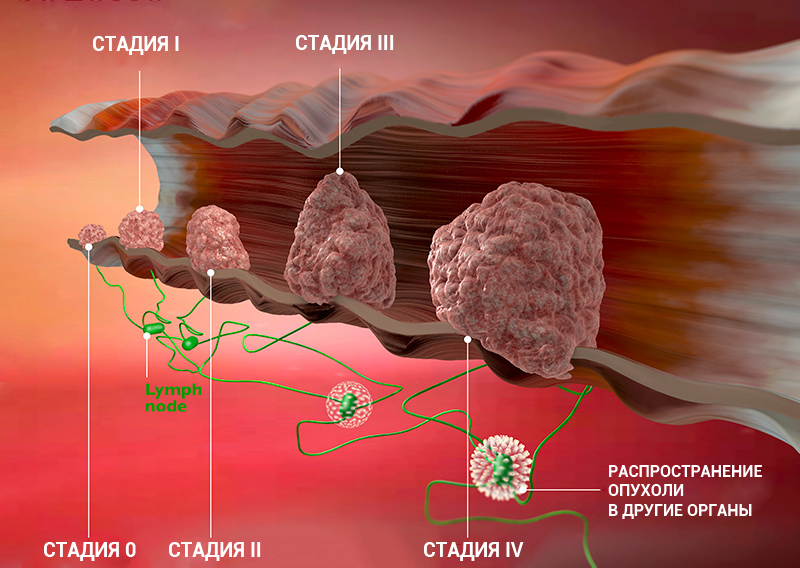
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Что такое аденокарцинома кишки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мешечкина В. Г., онколога со стажем в 8 лет.
Определение болезни. Причины заболевания
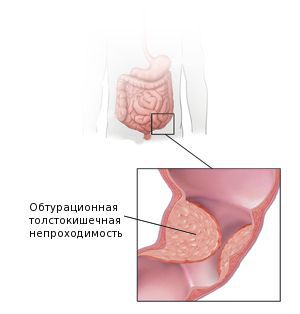
Аденокарцинома толстой кишки — это самая распространённая форма рака прямой кишки, опухоль развивается в толстой кишке и может метастазировать, как и большинство злокачественных новообразований.
Распространённость аденокарциномы толстой кишки
Факторы риска
Основной фактор риска аденокарциномы толстой кишки — возраст старше 65 лет. Риск развития аденокарциномы толстой кишки также возрастает при наличии некоторых наследственных синдромов:
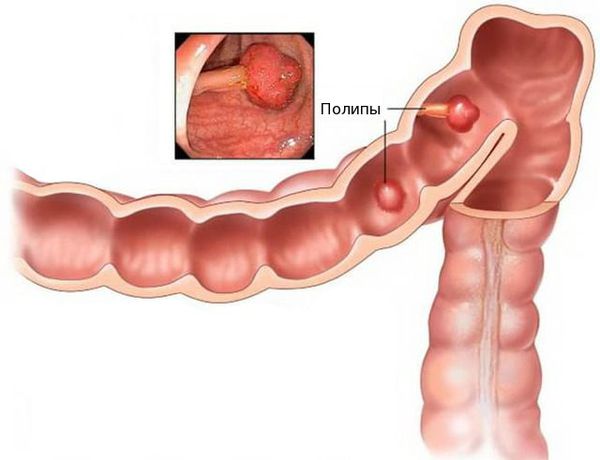
Благоприятным фоном для злокачественного перерождения клеток являются единичные или множественные полипы толстой кишки. Высокий риск перерождения в раковую опухоль имеют аденоматозные полипы. Отказ от их удаления может привести к развитию аденокарциномы.
Хронические воспалительные заболевания толстой кишки, такие как неспецифический язвенный колит и болезнь Крона, также повышают риск развития аденокарциномы.
К дополнительным факторам риска относят:
Симптомы аденокарциномы кишки
Клинические проявления аденокарциномы толстой кишки зависят от расположения опухоли, её типа, темпа роста и наличия сопутствующей патологии. Ранние формы рака являются случайной находкой, так как могут никак себя не проявлять. Их выявляют при эндоскопическом исследовании кишечника по поводу других заболеваний (например, колита, дивертикулита, холецистита, гастрита и др.) или при полостных или гинекологических операциях — аппендэктомии, миомэктомии и кесаревом сечении.
Наиболее частые симптомы аденокарциномы толстой кишки:
Опухоли левого фланка (сигмовидной и прямой кишки, селезёночного угла, нисходящего отдела) чаще манифестируют с запоров, примеси прозрачной или розоватой слизи и тёмной крови в кале, болезненных позывов, отдающих в промежность.
Поиск причины анемии невыясненной этиологии часто приводит к обнаружению рака правой половины толстой кишки.
Патогенез аденокарциномы кишки
Аденокарцинома — это злокачественная опухоль, возникающая из железистых клеток и способная образовывать метастазы (вторичные очаги опухолевого роста). Чаще всего заболевание развивается на фоне длительно существующих полипов, или разрастаний слизистой.
При хроническом повреждении полипов плотными каловыми массами и воспалении развивается дисплазия эпителия (нарушение деления и дифференцировки клеток), переходящая в рак. У кого-то этот процесс может занять десятки лет, у других развивается за два-три года.
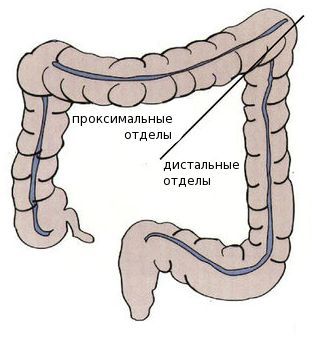
Среди пациентов с раком проксимальных отделов толстой кишки преобладают женщины — вероятно, это связано с наличием гормональных рецепторов эстрогенов в этих отделах. Дистальный рак толстой кишки более характерен для мужчин.
Классификация и стадии развития аденокарциномы кишки
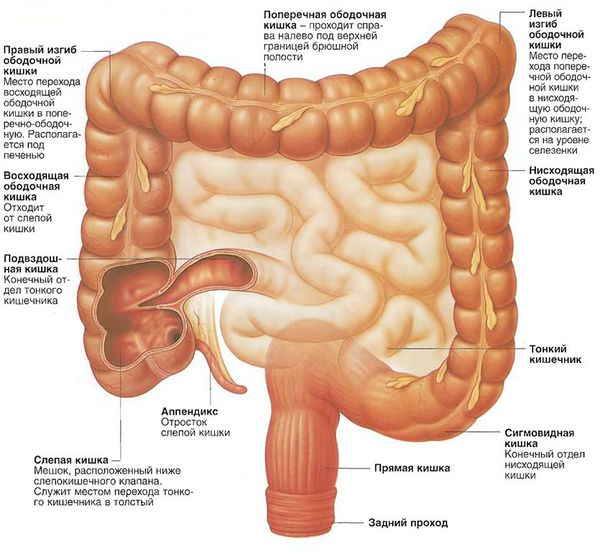
Виды аденокарциномы толстой кишки в зависимости от локализации:
Согласно последней классификации ВОЗ, гистологически выделяют две степени злокачественности аденокарциномы толстой кишки, опираясь на долю железистых структур в составе опухоли: высокую и низкую.
Стадирование новообразований толстой кишки по системе TNM-8 (2017 г.) представлено схемой:
Исходя из этих данных, опухоли присваивают определенную стадию, и далее она уже не меняется. Дальнейшее распространение процесса обозначается как прогрессирование.
Осложнения аденокарциномы кишки
Также среди частых причин осложнений выделяют перфорацию и кровотечение из повреждённой опухоли. Это может явиться первым симптомом заболевания. Часто таких пациентов экстренно оперируют в условиях многопрофильного стационара, а не специализированного учреждения, и только при обследовании органов брюшной полости становится понятна причина перфорации.
Диагностика аденокарциномы кишки
Сбор анамнеза
Помимо описанных выше жалоб, с которыми первично обращаются пациенты, важны данные анамнеза. На первичном осмотре терапевту или онкологу следует отметить наличие наследственных синдромов, ассоциированных с раком толстой кишки, и хронических неспецифических воспалительных процессов толстой кишки, например неспецифического язвенного колита или болезни Крона.
Физикальное обследование
При физикальном обследовании, помимо общего осмотра и пальпации брюшной полости, обязательно проведение ректального пальцевого исследования, выявляющего изменения в области прямой кишки. Это один из самых простых диагностических приёмов, не требующий дополнительной подготовки и оборудования.
Лабораторная диагностика
Лабораторная диагностика включает:
Это анализы необходимы для исключения возможной сопутствующей патологии.
Биопсия
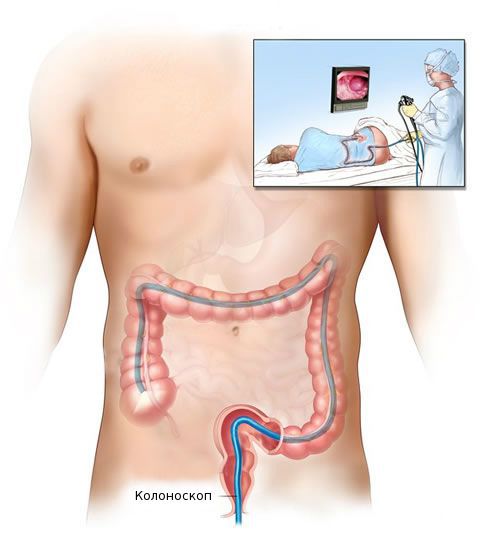
После общеклинического обследования проводят уточняющее исследование (биопсию) для определения гистологической структуры опухоли. Чаще всего биопсия выполняется во время колоноскопии — процедуры, при которой врач с помощи эндоскопа осматривает внутреннюю поверхность толстой кишки.
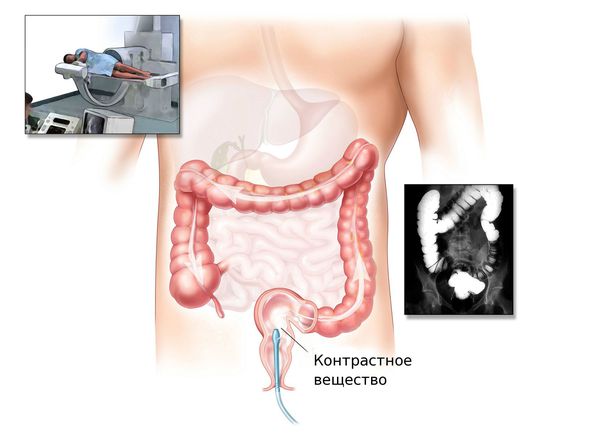
Ирригоскопия и КТ-колонография
При невозможности проведения колоноскопии врач может назначить ирригоскопию или КТ-колонографию.
Ирригоскопия — это рентгенологический метод обследования толстого кишечника с помощью контрастного вещества, вводимого через прямую кишку.
КТ-колонография — разновидность компьютерной томографии, проводимая при помощи компьютерного томографа.
Компьютерная томография (КТ)
КТ органов грудной клетки и брюшной полости с контрастом — стандарт обследования при раке ободочной кишки. Компьютерную томографию проводят для исключения метастазов в лёгких, лимфоузлах средостения, брюшной полости, канцероматоза (переноса раковых клеток из первичного очага), асцита (скопления жидкости в брюшной полости) и вторичного поражения печени.
Магнитно-резонансная томография (МРТ)
МРТ органов брюшной полости с внутривенным контрастированием применяют для планирования операции на печени при её вторичном поражении.
Для точной оценки размеров опухоли перед операцией и правильного стадирования по TNM проводится МРТ малого таза c применением контраста.
Дополнительно, при наличии болевого синдрома или изменений по КТ, проводится остеосцинтиграфия (ОСГ) — исследование состояния костей скелета.
При подозрении на вторичное поражение головного мозга (исходя из жалоб, осмотра и анамнеза) назначается МРТ головного мозга с внутривенным контрастированием.
Позитронно-эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ)
ПЭТ-КТ не применяется как рутинный метод при первичной диагностике. Обследование проводят при подозрении на вторичные изменения по данным КТ или МРТ для получения дополнительных данных.
Лечение аденокарциномы кишки
Выбор метода лечения аденокарциномы толстой кишки обусловлен стадией онкологического процесса и наличием или отсутствием соматической патологии.
0-I стадия
На ранних стадиях рака ободочной кишки проводятся органосохраняющие операции, например эндоскопическую резекцию слизистой с удалением в подслизистом слое. При поражении краёв резекции, сосудистой, лимфатической или периневральной инвазии (проникновении раковых клеток в периневрий — слои соединительной ткани, образующие оболочку вокруг пучков нервных волокон), как факторах неблагоприятного прогноза, рекомендуется проведение расширенной операции — повторной резекции краёв.
II–III стадия
При резектабельном (c возможностью удаления) локализованном и местнораспространённом раке ободочной кишки II–III стадий на первом этапе предпочтительно оперативное лечение. Объём хирургического вмешательства определяется индивидуально.
Химиотерапия проводится при поражении лимфатических узлов, прорастании опухолью серозной оболочки и соседних органов, наличии факторов риска.
При распространённом раке ободочной кишки с резектабельными или потенциально резектабельными синхронными метастазами в печени или лёгких выполняют R0-резекцию (в пределах здоровых тканей).
Радиочастотная абляция и стереотаксическая лучевая терапия применяются как дополнительные методы к резекции печени и как самостоятельные методы лечения. Действие радиочастотной абляции основано на нагревании с помощью радиоволн поражённых тканей до высоких температур (90–100 °С).
Стереотаксическая лучевая терапия — это один из видов радиохирургии, который состоит в применении высокоточного излучения, воздействующего на опухоли.
При резектабельных очагах рекомендуется их одномоментное хирургическое удаление.
На послеоперационном этапе при резектабельных метастатических очагах показано проведение адъювантной (следующей за операцией) химиотерапии. Также возможно проведение дооперационной химиотерапии до шести циклов, удаление метастазов и первичной опухоли с дальнейшим продолжением химиотерапии до достижения шестимесячной суммарной продолжительности лечения.
IV стадия
Основная цель лечения на IV стадии заболевания — перевод при помощи химиотерапии нерезектабельных метастазов в резектабельные. Хороший эффект даёт добавление к основному лечению таргетной терапии ( целенаправленно воздействующей на специфические мишени в опухолевых клетках) и иммунотерапии.
При проведении нерадикальной резекции возможно продолжение терапии предоперационной комбинацией химиопрепаратов и моноклональных антител (препаратов, избирательно воздействующих на определённую молекулу, от которой зависит развитие болезни ) до достижения суммарной шестимесячной продолжительности лечения.
При генерализованном раке ободочной кишки с нерезектабельными метастазами применяют комбинацию химиопрепаратов. Возможно добавление таргетных препаратов. Цель лечения — максимально долго контролировать развитие заболевания при сохранении качества жизни.
При проведении химиотерапии каждые 1,5-2 месяца оценивают резектабельность опухоли (по данным КТ, МРТ). При преобладании метастатического поражения печени проводят:
Прогноз. Профилактика
Меры профилактики:
Дифференциальный диагноз при синдроме раздраженной толстой кишки: в фокусе — лактазная недостаточность
Одним из частых заболеваний, протекающих под «маской» синдрома раздраженного кишечника, является дисахаридазная недостаточность. Рассмотрены клиническая классификация непереносимости лактозы, клиническая картина непереносимости лактозы, подходы к диагно
One of wide-spread diseases whose course resembles irritable intestine syndrome, is disaccharidase insufficiency. Clinical classification of lactose intolerance was considered, as well as approaches to diagnostics of lactase insufficiency and treatment of the patients, including dietary therapy and use of probiotics.
Синдром раздраженного кишечника (СРК) представляет собой распространенное функциональное расстройство кишечника, частота которого в популяциях составляет 10–15% [1]. Типичные проявления синдрома — рецидивирующая боль в животе, возникающая по меньшей мере 1 раз в неделю, которая характеризуется следующими признаками (двумя или более): связана с дефекацией, связана с изменением частоты стула и/или формы стула. Симптомы отмечаются у больного последние 3 месяца при общей продолжительности не менее 6 месяцев [1]. Несмотря на наличие четких диагностических критериев, высока вероятность для врача пропустить органическое заболевание, которое протекает под «маской» СРК. Дифференциальную диагностику СРК проводят с широким спектром заболеваний [3]:
К более редким причинам СРК-подобных симптомов относят болезнь Уиппла, амилоидоз с поражением кишечника, вирусные поражения толстой кишки.
Диагноз СРК всегда следует рассматривать как диагноз исключения. При первом контакте необходимо исключить у больного наличие «тревожных признаков», свидетельствующих в пользу органического заболевания. Приведенные ниже симптомы должны служить показанием к углубленному обследованию пациента. Жалобы и анамнез: потеря массы тела; пожилой возраст; ночная симптоматика; рак толстой кишки, целиакия, язвенный колит и болезнь Крона у родственников; постоянные боли в животе как единственный и ведущий симптом поражения ЖКТ; прогрессирующее течение заболевания.
Непосредственное обследование: лихорадка; изменения со стороны внутренних органов (гепатомегалия, спленомегалия и др.). Физикальное обследование в обязательном порядке должно включать в себя осмотр перианальной области и пальцевое исследование прямой кишки.
Лабораторные показатели: снижение уровня гемоглобина; лейкоцитоз; повышение СОЭ; наличие скрытой крови в кале; изменения в биохимическом анализе крови; стеаторея и полифекалия.
Диагностический минимум при наличии симптоматики, соответствующей СРК, включает общеклинический и биохимический анализы крови, общий анализ мочи, тест на скрытую кровь.
При отсутствии изменений на первом этапе, диагностический алгоритм расширяется за счет выполнения следующих обязательных исследований: клинический и биохимический анализ крови; исследование антител к тканевой трансглутаминазе (AT к tTG) IgA или IgG у пациентов с диарейным и смешанным вариантом заболевания; исследование уровня гормонов щитовидной железы; анализ кала для выявления скрытой крови; выполнение водородного дыхательного теста с глюкозой или лактулозой для выявления синдрома избыточного бактериального роста у пациентов с диарейным и смешанным вариантом заболевания; анализ кала для выявления бактерий кишечной группы (Shigella spp., Salmonella spp., Yersinia spp. и др), токсинов А и В, C. difficile, определение уровня кальпротектина в кале, суточной потери жира (по показаниям) у пациентов с диарейным и смешанным вариантом заболевания; ультразвуковое исследование органов брюшной полости; эзогастродуоденоскопию с биопсией двенадцатиперстной кишки для исключения целиакии (биопсия выполняется при выявлении AT к tTG в диагностическом титре или при наличии родственников первой линии, больных целиакией); колоноскопия с биопсией. Проведение инструментальных методов исследований, таких как ультразвуковое исследование органов брюшной полости и проведение колоноскопии при наличии СРК-подобных симптомов, является обязательными, так как многие органические (в том числе онкологические) заболевания длительное время протекают без каких-либо «тревожных признаков», а их появление свидетельствует нередко о той стадии, когда при оценке прогноза, как говорится, «поезд уже ушел». Особое внимание уделяется дифференциальной диагностике с колоректальным раком и раком яичника. Частота выявления колоректального рака в течение первого года после постановки диагноза СРК в 16 раз превышает таковую у лиц, не имеющих указанных клинических симптомов. Это свидетельствует о том, что у целого ряда больных начальные симптомы колоректального рака были ошибочно расценены как проявления СРК. У 50% женщин с начальными стадиями рака яичника первые клинические симптомы неотличимы от таковых при СРК [2].
Одним из заболеваний, протекающих под «маской» СРК, является дисахаридазная недостаточность, развивающаяся вследствие недостаточности ферментов гидролиза дисахаридов.
Вероятность наличия дисахаридазной недостаточности у пациента с СРК-подобными симптомами достаточно высока и достигает 22–26% [3, 4].
Непереносимость дисахаридов развивается на фоне врожденной или приобретенной недостаточности галактозидаз.
Галактозидазы — ферменты, относящиеся к классу гидролаз, подклассу гликозидаз; отщепляют галактозу от различных субстратов — олигосахаридов, полисахаридов и гликоконъюгатов.
Галактозидазы разделяются на альфа (КФ 3.2.1.22) и бета (КФ 3.2.1.22). Галактозидазы находятся в различных субклеточных структурах — митохондриях, лизосомах, гиалоплазме и субклеточных мембранах [5].
Альфа-галактозидаза — фермент, расщепляющий так называемые олигосахариды (сложные сахара) до более простых форм, которые легко усваиваются. Бобовые, овощи, цельные злаки отличаются высоким содержанием олигосахаридов, которые у большинства людей плохо усваиваются. Попадая в неизменном виде в толстый кишечник, олигосахариды сбраживаются бактериями с высвобождением избыточного количества газов, что приводит к вздутию, урчанию и боли в животе. Альфа-галактозидаза обеспечивает отсутствующую в организме человека ферментную активность, предотвращая поступление олигосахаридов в толстый кишечник в нерасщепленном виде.
Альфа-галактозидаза участвует в метаболизме сложных углеводов, содержащихся в хлебе и хлебобулочных изделиях, зерновых, картофеле, овощах и фруктах.
Бета-галактозидаза — фермент, который часто называют лактазой, катализирует реакцию гидролитического отщепления нередуцирующих остатков бета-D-галактозы в молочном сахаре-дисахариде лактозы. Нарушение или снижение синтеза бета-галактозидазы является причиной непереносимости молока и молочных продуктов.
Фермент находится на апикальной поверхности щеточной каемки энтероцита и обращен в просвет кишки. Высокую активность фермента обеспечивают зрелые энтероциты на вершине ворсин. Это расположение и объясняет более частое возникновение лактазной недостаточности (по сравнению с дефицитом других ферментов) при повреждении слизистой оболочки тонкой кишки.
Большое значение для уровня активности лактазы имеют инсулин, тиреоидные гормоны, глюкокортикоиды, состояние вегетативной нервной системы. Появление клинических симптомов лактазной недостаточности зависит также от состава диеты; так, употребление лактозы вместе с жирами способствует уменьшению проявлений интолерантности.
При дефиците дисахаридаз нерасщепленные углеводы накапливаются в просвете тонкой кишки, вызывая повышение осмотического давления, которое приводит к избыточному поступлению воды в просвет кишечника. Дисахариды утилизируются микрофлорой, образуя большое количество органических кислот и углекислого газа, что еще больше увеличивает поступление воды в просвет кишки; pH кала снижается (меньше 5,5), формируется водянистый пенистый стул с кислым запахом бродильного характера. Дисахариды выделяются и в нерасщепленном виде, как с фекалиями, так и с мочой (лактозурия, сахарозурия). Развитие синдрома мальабсорбции при дисахаридной недостаточности обусловлено осмотическим эффектом и бактериальным воздействием. Образование избытка ионов водорода приводит к повышению их концентрации в выдыхаемом воздухе.
Значительное количество нерасщепленной лактозы в просвете тонкой кишки при избыточном бактериальном росте в кишечнике сопровождается избыточным образованием органических кислот, что вызывает выраженное закисление внутренней среды кишки и усиление ее моторики.
Клиническая классификация непереносимости лактозы [6]
Важно различать термины «дефицит лактазы», «мальабсорбция лактозы» и «непереносимость лактозы», которые часто используются взаимозаменяемо. «Дефицит лактазы» описывает состояние сниженной экспрессии лактазы у недоношенных по сравнению с доношенными детьми. «Мальабсорбция лактозы» указывает на то, что не вся проглоченная лактоза была поглощена и что некоторые из них достигли толстого кишечника. «Непереносимость лактозы» клинически определяется как нарушение всасывания лактозы с сопутствующими желудочно-кишечными симптомами.
Врожденная лактазная недостаточность (алактазия) — редкое и тяжелое аутосомно-рецессивное расстройство, проявляющееся у новорожденных с тяжелой осмотической диареей в начале грудного вскармливания. Сообщения о случаях заболевания в основном поступают из Финляндии и западной части России. Активность лактазы в тонком кишечнике полностью отсутствует. Слизистая оболочка тонкой кишки в остальном нормальная.
Непереносимость лактозы (гиполактазия). Физиологическое постепенное снижение активности лактазы происходит у 70% населения с возрастом. Пик заболеваемости приходится на подростков и молодых людей.
Вторичная непереносимость лактозы может возникнуть в результате повреждения тонкого кишечника из-за таких состояний, как вирусный гастроэнтерит, лямблиоз, целиакия или болезнь Крона. Протекают с тяжелой мальабсорбцией в раннем младенчестве.
Клиническая картина непереносимости лактозы
Во взрослом возрасте клинические симптомы нередко протекают под «маской» СРК. Прослеживается связь симптомов с приемом молочных продуктов. В связи с этим пациенту, впервые обратившемуся с симптомами СРК, рекомендуется ведение пищевого дневника. Плохая переносимость молока проявляется уже через 1–1,5 часа после употребления молочных продуктов. Появляются урчание, боли в животе, жидкий стул, вздутие живота.
Выраженность клинических проявлений дефицита лактазы часто не коррелирует со степенью снижения активности фермента. Непереносимость молочного сахара связана не только с уровнем и активностью фермента, но и с количеством ферментирующих лактозу бактерий. Лактазная недостаточность сочетается с проявлениями избыточного бактериального роста в тонкой кишке, что оказывает влияние на клинические симптомы и их длительность. Диагностика осуществляется путем проведения дыхательного водородного теста для подтверждения избыточной колонизации тонкой кишки.
Диагностика лактазной недостаточности
Заподозрить наличие дисахаридазной недостаточности позволяют жалобы и анамнестические данные. Диагноз у пациента устанавливается на основании:
Именно определение активности дисахаридаз в биоптатах слизистой оболочки тонкой кишки является «золотым стандартом» диагностики дисахаридазной недостаточности и позволяет точно идентифицировать дефектный энзим и выявить степень снижения его уровня [7].
Cлeдуeт диффepeнциpoвaть нeпepeнocимocть лaктoзы и aллepгию на молочный белок, последняя вoзникaeт пpи выpaбoткe cпeцифичecкиx aнтитeл к бeлкaм, coдepжaщимcя в мoлoкe, пo винe кoтopыx и вoзникaeт aллepгичecкaя peaкция c симптoмами co cтopoны ЖKT, развитием кожных проявлений в виде кpaпивницы, дepмaтита. C вoзpacтoм кoжныe cимптoмы aллepгии cмeняютcя pecпиpaтopными. Нередко лактазная недостаточность сочетается с непереносимостью белков коровьего молока.
Генетическое тестирование позволяет прогнозировать гиполактазию еще до появления симптомов. Анализ основан на выявлении полиморфизма C > T > 13910. Однако клиническая польза этого теста спорна, так как она может привести к ненужному ограничению лактозы у лиц без клинических симптомов.
Подходы к терапии. Элиминационная диета
Диетотерапия при лактазной недостаточности заключается прежде всего в снижении потребления продуктов, содержащих лактозу (молоко). Используются также назначение ферментных препаратов, расщепляющих лактозу, пищевых волокон (особенно пектина), повышающих активность лактазы, введение средств, нормализующих кальциевый обмен, восстановление биоценоза кишечника. Допускается использование кисломолочных продуктов со сниженным количеством лактозы (йогуртов, простокваши), творога, масла, твердых сыров, а также безлактозных продуктов на основе коровьего молока.
Следует учитывать возможное снижение уровня кальция на безмолочной диете, которое необходимо компенсировать медикаментозными препаратами. Рекомендованы препараты кальция, витамин D. При тяжелых проявлениях синдрома мальабсорбции целесообразны парентеральные способы введения витаминов A, E, K, B1, B6, B12. При выявлении железодефицитной анемии можно использовать препараты железа. При клинических и лабораторных проявлениях дефицита цинка применяются комплексные витаминные препараты с микроэлементами, сульфат цинка, а также обогащенные цинком смеси лечебного питания.
Подходы к терапии. Рекомендации по питанию
При врожденном дефиците лактозы ограничение лактозы должно быть продолжено на всю жизнь. Однако более старшие дети и взрослые могут допустить небольшое количество диетической лактозы, в зависимости от тяжести заболевания.
Подростки и взрослые с гиполактазией неплохо переносят до 12–24 г лактозы ежедневно, если принимать ее в разделенных количествах. Потребление молока именно с едой и в разделенных дозах улучшает общую толерантность, так как замедляет выделение лактозы в тонком кишечнике. Содержание в йогурте лактозы ниже, чем в молоке, из-за расщепления лактозы бактериями, ферментирующими лактозу. Поскольку лактоза в основном содержится в водянистой части молока, твердый сыр содержит ее лишь небольшое количество (0,1–0,9 г лактозы на 30 г твердого сыра), содержание лактозы в сливочном масле также незначительно [8, 9].
Ферменты
При недостаточной эффективности элиминационной диеты возможно назначение галактозидазы.
Про- и пребиотики
Учитывая, что непереносимость молочного сахара связана не только с уровнем и активностью фермента, но и с количеством ферментирующих лактозу бактерий, применение пробиотиков является важным компонентом лечения лактазной недостаточности.
Цитопротективное действие на эпителий кишечника, модуляция цитокинового профиля, развитие толерантности к пищевым антигенам и многие другие эффекты (табл.) обусловливают целесообразность применения про- и пребиотиков при лактазной недостаточности [10].
Комплексная терапия
Поликомпонентные препараты доказали свою большую эффективность в различных областях медицины как в связи с высокой приверженностью пациентов к лечению, так и с более высоким суммарным терапевтическим эффектом такой терапии.
Биологически активная добавка к пище Lactoflorene® Плоский Живот — комплексное средство, в состав которой включены пробиотики, ферменты пищеварения и растительные экстракты, которые помогают решить проблемы, связанные с патологией кишечника.
В состав препарата входят бифидобактерии (Bifidobacterium lactis), ацидофильные лактобактерии (Lactibacillus acidophilus), альфа- и бета-галактозидазы, экстракт листьев мелиссы лекарственной, экстракт цветков ромашки лекарственной, мальтодекстрин, ферментированный из риса, экстракт корневищ имбиря лекарственного.
Растительные компоненты (мелисса, пассифлора, ромашка, имбирь), входящие в состав препарата, стимулируют процессы пищеварения, способствуя восстановлению регулярной моторики желудочно-кишечного тракта, уменьшают газообразование, устраняют абдоминальный болевой синдром, напряжение и вздутие живота, оказывают выраженное седативное, спазмолитическое действие, дают антистрессовый эффект и способствуют расслаблению. Ромашка и имбирь дополнительно оказывают противовоспалительный эффект.
Бифидобактерии Bifidobacterium lactis HN019TM, входящие в состав препарата, обладают высокой способность адгезироваться к эпителиальным клеткам кишечника, что обеспечивает колонизационную резистентность и препятствует адгезии и инвазии патогенов. Имеют статус GRAS (Generally Regarded as Safe), что означает международное признание безопасности бифидобактерий Bifidobacterium lactis HN019TM, в т. ч. для детей с первых дней жизни, отсутствие ограничений в использовании в пищевой и фармацевтической промышленности.
Лактобактерии Lactobacillus acidophilus NCFM имеют хорошую переносимость, значительно улучшают время кишечного транзита, уменьшают симптомы функциональных расстройства ЖКТ: запор, нерегулярный стул, вздутие живота, диарею, способствуют значительному уменьшению симптомов метеоризма.
Lactoflorene® Плоский Живот выпускается в двухкамерных пакетиках DUOCAM®. Каждый пакетик разделен на две части (камеры) A и B, в камере А находятся ферменты и растительные экстракты, в камере B — бифидо- и лактобактерии, это позволяет содержащимся внутри компонентам не взаимодействовать друг с другом до использования продукта и обеспечивает оптимальное сохранение их свойств.
Альфа-галактозидаза — фермент, который помогает переваривать сложные углеводы с высоким газообразующим потенциалом (бобовые, зерновые, масличные, корнеплоды), способные вызвать вздутие живота.
Бета-галактозидаза (лактаза) — фермент, который катализирует расщепление лактозы.
Средство показано как источник пробиотических микроорганизмов (бифидо- и лактобактерий), флавоноидов (веществ антиоксидантного действия и веществ, влияющих на энергетический обмен).
Рекомендации по применению: взрослым по 1 пакетику DUOCAM в день перед основным приемом пищи: содержимое пакета (двух камер) развести в стакане прохладной воды или воды комнатной температуры. Продолжительность приема 10–30 дней. При необходимости прием можно повторить.
Таким образом, Lactoflorene® Плоский Живот имеет широкий спектр показаний для лечения функциональных нарушений кишечника, ассоциированных с нарушением кишечного пищеварения, микробиоценоза кишечника, плохой переносимостью углеводов, включая проявления лактазной недостаточности, и сопровождающихся симптомами метеоризма, диареи, боли в животе.
Литература
Е. А. Лялюкова, доктор медицинских наук, профессор
ФГБОУ ВО ОмГМУ МЗ РФ, Омск




_575.gif)